WPROWADZONE ZMIANY (Polska)
NOWY REJESTR GIS
Powiadomienia GIS dokonuje się w formie elektronicznej przez wprowadzenie danych do znowelizowanego formularza powiadomienia, który został udostępniony w lutym 2020 r. [8]. Modernizacja elektronicznego systemu powiadamiania (ESP) była m.in. skutkiem nowelizacji przepisów i zgodnie z założeniem ustawodawcy miała poprawić nadzór nad produktami notyfikowanymi oraz ułatwić przedsiębiorcom składanie powiadomień, a konsumentom wyszukiwanie informacji o produktach. Nowy formularz został wyraźnie zmodyfikowany. Uzupełnianie powiadomienia następuje na podstawie list zdefiniowanych składników. Dotychczas listy zamknięte stanowiły jedynie witaminy i składniki mineralne. W tej chwili także składniki roślinne należy wybierać z list, które niestety nie zawierają wszystkich składników stosowanych w suplementach, czasami nawet tych, które zostały dopuszczone przepisami unijnymi w sprawie nowej żywności.
Aktualnie ESP ma jeszcze wiele ograniczeń technicznych, które powodują, że powiadomienie jest czasami niekompletne lub wręcz niemożliwe bez kontaktu z GIS oraz oczekiwania na dodanie składników do list czy też uwzględnienie odpowiednich jednostek.
W obowiązujących przepisach nadal brakuje uregulowań odnośnie do ewentualnej korekty powiadomień GIS. Ustawa i rozporządzenia nie zawierają wymogów odnośnie do aktualizacji danych dotyczących powiadomienia GIS ani związanych z produktem, ani z jego oznakowaniem. Jednakże zgodnie z utrwaloną praktyką stosowaną przez GIS, aby odróżnić produkty o podobnej charakterystyce, wszelkie merytoryczne zmiany produktu wymagają złożenia odrębnego powiadomienia [3].
Składanie powiadomień pozostało więc uciążliwe dla firm, ze względu na trudności techniczne i rozciągnięte w czasie postępowanie, jak również niepewność prawną co do ostatecznego stanowiska urzędu.
OCENA SKŁADNIKÓW WEDŁUG NOWYCH, ROZSZERZONYCH REGUŁ
Intensywne prace rozpoczął Zespół ds. Suplementów Diety – organ doradczy GIS działający w ramach Rady Sanitarno-Epidemiologicznej, o której mowa w art. 9 ustawy z dnia 14 marca 1985 r. o Państwowej Inspekcji Sanitarnej [16]. Po pierwszej transzy 21 uchwał przyjętych w 2019 r., dotyczących maksymalnych zawartości niektórych witamin i innych składników suplementów diety oraz możliwości stosowania niektórych składników, w lutym 2020 roku Zespół przyjął kolejnych 7 uchwał zawartych w tabeli 1 [4].
| STRESZCZENIE: |
| Zgodnie z procedurami określonymi w ustawie z dnia 25 sierpnia 2006 r. o bezpieczeństwie żywności i żywienia [18] pierwsze wprowadzenie do obrotu niektórych rodzajów środków spożywczych, m.in. suplementów diety, jest zgłaszane do Głównego Inspektora Sanitarnego (GIS). W tym zakresie prawo polskie pozostało niezmienne. Niemniej jednak znowelizowano przepisy wykonawcze do niniejszej ustawy. Z dniem 1 stycznia 2020 r. weszło w życie rozporządzenie Ministra Zdrowia z 21 grudnia 2019 r. zmieniające rozporządzenie w sprawie wzoru formularza powiadomienia o produktach wprowadzanych po raz pierwszy do obrotu na terytorium Rzeczypospolitej Polskiej, rejestru produktów objętych powiadomieniem oraz wykazu krajowych jednostek naukowych właściwych do wydawania opinii [10]. Nastąpiła również zmiana w podejściu GIS do oceny tych produktów, w wyniku czego można zaobserwować dość istotną różnicę w funkcjonowaniu podmiotów na rynku. Na poziomie UE przedstawiono propozycje nowych regulacji, które przyniosą poważne skutki dla przemysłu. |
| SUMMARY: |
| In accordance with the procedures set out in the Act of 25 August 2006 on the safety of food and nutrition [18], the first marketing of certain types of foodstuffs, including dietary supplements is subject to notification to the Chief Sanitary Inspector (GIS). In this respect, Polish law has remained unchanged. Nevertheless, the implementing provisions to the above-mentioned the law. On January 1, 2020, the Regulation of the Minister of Health of December 21, 2019, amending the regulation on the model form for the notification on products placed on the market for the first time in the territory of the Republic of Poland, entered into force, the register of products covered by the notification and the list of national scientific units competent for to issue opinions [10]. There has also been a change in the GIS approach to the evaluation of these products and it has caused quite a significant difference in the functioning of entities on the market. New regulations have been proposed at EU level that will have serious industrial effects. TITLE: Food Supplements – Review of Changes in Polish and Community Law |
Uchwały Zespołu ds. Suplementów Diety zawierają ocenę ryzyka oraz wytyczne, którymi kierują się organy Państwowej Inspekcji Sanitarnej w prowadzonym nadzorze oraz przy analizie składanych powiadomień. Uchwały są również wskazówką dla przedsiębiorców odnośnie do maksymalnych poziomów witamin i składników mineralnych akceptowanych w suplementach diety. W przypadku braku zgodności produktu z uchwałą GIS wszczyna postępowanie wyjaśniające mające na celu ustalenie, czy produkt spełnia wymagania stawiane suplementom diety. Nowym trendem jest zobowiązywanie podmiotów do przedstawiania wyników analiz laboratoryjnych niektórych substancji ograniczających (toksycznych) występujących w składnikach roślinnych, np. badań produktów finalnych w kierunku obecności związków cyjanogennych, alkaloidów, glikozydów i wielu innych.
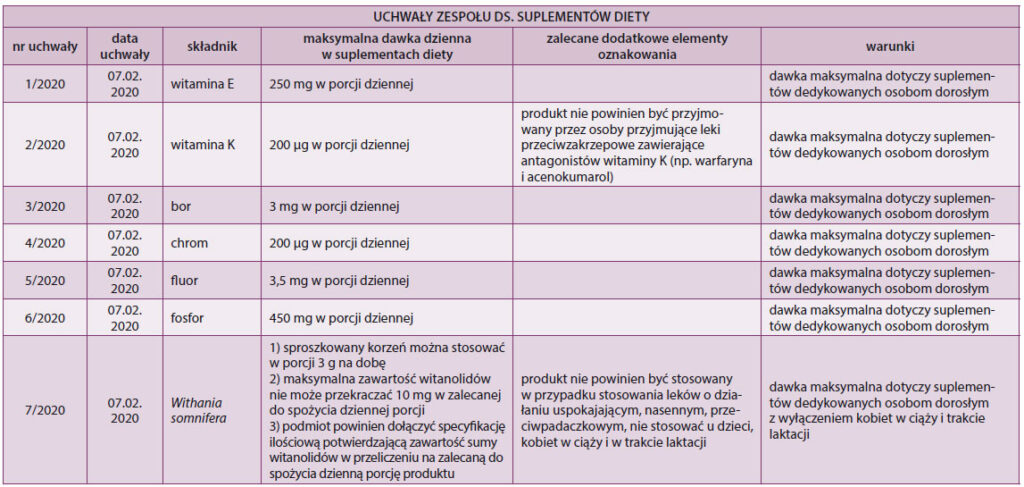
Table 1. Resolutions of the Team for Diet Supplements (GIS)
OPINIOWANIE PRODUKTÓW
W ramach postępowania wyjaśniającego GIS może zażądać od przedsiębiorcy udokumentowania, że środek spożywczy spełnia wymagania, o których mowa w art. 30 ust. 1 ustawy, w szczególności do przedstawienia opinii Zespołu ds. Suplementów Diety, opinii jednostki naukowej bądź Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL), w którym sprawy rozstrzygane są indywidualnie [18].
Postępowania prowadzone przez GIS w latach 2019-2020 wskazują na znaczny wzrost znaczenia opinii naukowych w tym procesie. Przykładowo w przypadku suplementów adresowanych do niemowląt i małych dzieci każdorazowo należy przedstawić opinię dotyczącą prawidłowości kwalifikacji i bezpieczeństwa produktu. W ostatnim czasie mamy także do czynienia z większą liczbą opinii opracowywanych przez Komisję ds. Kwalifikacji Produktów z Pogranicza w URPL. W roku 2020 wzrosła ona do 20. Jednocześnie wzrósł odsetek produktów uznanych za zgodne z definicją produktu leczniczego.
W 2020 roku dyskutowano też wprowadzenie do ustawy z dnia 25 sierpnia 2006 r. o bezpieczeństwie żywności i żywienia artykułu 27b – nakładającego obowiązek uiszczenia opłaty od reklamy suplementów diety. Projekt zakładał, że potrzeba wprowadzenia opłaty wynika z niskiego poziomu wiedzy Polaków na temat suplementów diety oraz świadomości istotnych różnic między lekami bez recepty (OTC) a suplementami diety, a także wpływu reklamy medialnej na wybór żywności przez konsumentów. Ustawodawca w ocenie skutków regulacji nie był jednak w stanie obiektywnie wskazać, w jaki sposób wprowadzenie podatku od reklamy ma wyeliminować tego rodzaju ryzyko. Ostatecznie również w ustawie o zmianie niektórych ustaw w związku z promocją prozdrowotnych wyborów konsumentów, tzw. ustawie cukrowej z dnia 28 stycznia 2020 r., zrezygnowano ze zmian ustawy o bezpieczeństwie żywności i żywienia, w tym tych z zakresu opodatkowania reklam od suplementów diety [7]. Co więcej, obowiązek uiszczania opłaty od napojów z dodatkiem substancji o właściwościach słodzących oraz kofeiny lub tauryny w produkcie gotowym do spożycia nie obejmuje m.in. suplementów diety.
Nie tylko zmiany na rynku krajowym powinny być przedmiotem zainteresowania firm wprowadzających do obrotu suplementy diety. Kluczowe dla Polski jako kraju członkowskiego UE są regulacje wspólnotowe, które ulegną istotnym zmianom w najbliższym czasie.
KLUCZOWE PROBLEMY I ROZWIĄZANIA na poziomie UE
BRAK DOZWOLONYCH SUBSTANCJI DODATKOWYCH W SD DLA NIEMOWLĄT I MAŁYCH DZIECI
Problem z suplementami dla niemowląt i małych dzieci pojawił się, gdy ustawodawca unijny na etapie stanowienia przepisów prawnych nie przewidział możliwości stosowania dodatków do tej specyficznej kategorii żywności. Mamy więc do czynienia ze swoistym, niezamierzonym brakiem regulacji w tym zakresie. Luka prawna została spostrzeżona już przed
kilkoma laty i od tego czasu Komisja Europejska prowadzi dyskusje odnośnie do sposobu rozwiązania wspomnianego problemu. Prace zmierzają do utworzenia kategorii 17.3 (Suplementy dla niemowląt i małych dzieci) oraz listy substancji dozwolonych w rozporządzeniu Parlamentu Europejskiego i Rady (WE) nr 1333/2008 z dnia 16 grudnia 2008 r. w sprawie dodatków do żywności [14]. Jednocześnie rozważa się dopuszczenie tokoferoli – E 306 i E 307 oraz kwasu cytrynowego E 330 do suplementów w postaci płynnej zawierających wyłącznie witaminę D i/lub witaminę K pojedynczo lub w kombinacji.
Co istotne, we wszystkich pozostałych przypadkach stosowania substancji dodatkowych (tj. innych niż E 306, E 307 i E 330 w suplementach dla niemowląt i dzieci zawierających witaminę D i witaminę K) wymagana jest standardowa procedura, tj. zgłoszenie formalnego wniosku zawierającego wszystkie niezbędne elementy (m.in. uzasadnienie technologiczne, ocena spożycia danej substancji dodatkowej wraz z suplementem diety, proponowane dawki, opis danego produktu itp.). Wnioski składane do Komisji Europejskiej dotyczą stosowania danej substancji dodatkowej w konkretnym produkcie, w ściśle określonej dawce. A zatem w przypadku dodatku do suplementów diety dla niemowląt i dzieci we wniosku opisuje się rodzaj suplementu: jego postać, substancję czynną, grupę wiekową oraz uzasadnienie technologiczne.
Przy okazji dyskutowania postaci płynnych suplementów diety zajmowano się kolejnym novum, tj. propozycją definicji syropu – uwzględnia ona możliwość stosowania substancji słodzących zwanych poliolami, przy czym substancje słodzące byłyby dopuszczone wyłącznie do syropów bez dodatku cukru.
Nastąpiły również zmiany kryteriów czystości substancji dodatkowych. Wprowadzono m.in. nowe wymagania dotyczące dwutlenku tytanu, czyli białego barwnika powszechnie stosowanego również w suplementach diety – mediana wielkości cząsteczek barwnika wynosi powyżej 100 nm, a ilość cząsteczek o wielkości poniżej 100 nm wynosi poniżej 50% [9].
Nowością jest to, że KE zajęła się dodatkowo substancjami aromatycznymi stosowanymi w żywności dla niemowląt i dzieci.
Coraz częściej podejmowane są również inicjatywy na podstawie art. 8 ust. 2 rozporządzenia nr 1925/2006 Parlamentu Europejskiego i Rady z dnia 20 grudnia 2006 r. w sprawie dodawania do żywności witamin i składników mineralnych oraz niektórych innych substancji [11].
We wrześniu 2020 r. m.in. przedstawiono projekty rozporządzeń zmieniających zał. III pkt B i C rozporządzenia 1925/2006 w zakresie stosowania w żywności i suplementach diety [5]:
- gatunków botanicznych zawierających pochodne hydroksyantracenowe (HAD), tj. zakazu stosowania aloesu, senesu, rzewienia i ich przetworów zanieczyszczonych tymi związkami (zmodyfikowana wersja),
- monakoliny ze sfermentowanego czerwonego ryżu, tj. możliwości stosowania monakoliny w ilości nie większej niż 3 mg, pod warunkiem podania w oznakowaniu szeregu ostrzeżeń,
- ekstraktu z zielonej herbaty zawierającego 3-galusan (-) epigallokatechiny stosowanego w żywności, w tym w napojach i suplementach diety – w ilości maksymalnej 800 mg 3-galusanu (-) epigallokatechiny.
Precedensowy projekt rozporządzenia zakazującego używania składników zawierających pochodne hydroksyantracenów został przyjęty 12.11.2020 r. przez Stały Komitet ds. Roślin, Zwierząt, Żywności i Pasz. To ogromne wyzwanie dla firm mających w swoim portfolio produkty zawierające aloes, senes czy rabarbar i ich przetwory. Umieszczenie w części A załącznika III Rozporządzenia nr 1925/2006 (tj. dotyczącego zakazu stosowania w żywności): „extracts from the leaf of Aloe species containing hydroxyanthracene derivatives” oznacza, że wszystkie składniki z liści Aloe barbadensis Miller i/lub różnych gatunków Aloe, głównie Aloe ferox Miller i ich mieszanek, z jakąkolwiek zawartością związków hydroksyantracenowych będą niedozwolone. EFSA uznała, że ekstrakt z całych liści aloesu jest genotoksyczny in vitro i rakotwórczy.
Z kolei wyciąg z korzenia i kłącza Rheum palmatum L. lub Rheum officinale Baillon albo ich hybrydy, wyciąg z liści lub owoców Cassia senna L., wyciąg z kory Rhamnus frangula L., Rhamnus purshiana DC – zawierające pochodne hydroksyantracenu – zostały włączone do załącznika III część C (Substancje podlegające kontroli przez Wspólnotę) rozporządzenia nr 1925/2006.
W konsekwencji należy więc spodziewać się dalszego procedowania projektów dotyczących zakazu stosowania monakoliny K, zielonej herbaty i innych kilkunastu składników.
Powrócił również temat ustalenia maksymalnych ilości witamin i składników mineralnych w suplementach diety i w żywności wzbogacanej, zainicjowany przez Niemcy.
ZANIECZYSZCZENIA
Nie można nie spostrzec intensywnie prowadzonych prac w ramach Grupy Roboczej ds. Zanieczyszczeń Środowiskowych i Przemysłowych Komisji Europejskiej. Nowe doniesienia naukowe w postaci opinii EFSA czy jednostek krajowych inicjują dyskusję merytoryczną w zakresie bezpieczeństwa żywności, zmierzającą finalnie do ustanowienia nowych ograniczeń prawnych.
Spośród najnowszych tematów warto zwrócić uwagę na takie kwestie jak:
- nadchloran – z dniem 1 lipca 2020 r. obowiązuje rozporządzenie nr 2020/685, zmieniające rozporządzenie nr 1881/2006, w którym określono najwyższe dopuszczalne poziomy (NDP) nadchloranu dla środków spożywczych, takich jak napary ziołowe i owocowe, suszone: 0,75 mg/kg. Wymóg ten dotyczy więc również suplementów diety w postaci herbatek, ziół do sporządzania naparów [8];
- alkaloidy pirolizydynowe – trwają prace nad rozporządzeniem ustanawiającym nowe wartości NDP w odniesieniu do alkaloidów pirolizydynowych dla wybranych środków spożywczych [6]. Uzgodniono, że w przypadku alkaloidów pirolizydynowych wartość granicy oznaczalności dla produktów w postaci stałej będzie wynosić 10 μg/kg każdego z alkaloidów, a w postaci ciekłej 0,15 μg/kg każdego z alkaloidów. NDP będą stosowane 24 miesiące po dacie opublikowania rozporządzenia – zgodnie z limitami wskazanymi w projekcie w tabeli 8 rozporządzenia Komisji (UE) zmieniającego rozporządzenie (WE) nr 1881/2006 w odniesieniu do najwyższych dopuszczalnych poziomów alkaloidów pirolizydynowych w niektórych środkach spożywczych:
| 8.4.6. | Suplementy diety zawierające składniki ziołowe () (***) z wyłączeniem suplementów diety wymienionych w punkcie 8.4.7. | 400 |
| 8.4.7. | Suplementy diety wytworzone z udziałem pyłku Pyłek i produkty wytworzone z udziałem pyłku | 500 |
- cyjanowodór: po opinii EFSA z 2019 r. (Evaluation of the health risks related to the presence of cyanogenic glycosides in foods other than raw apricot kernels) [2] podejmowane są dalsze działania zmierzające do ustalenia kryteriów dla metod oznaczania cyjanowodoru oraz alkaloidów opium. Granica oznaczalności (LOQ) ma wynosić 2 mg/kg. Wkrótce zostanie zaprezentowany projekt rozporządzenia dotyczącego pobierania próbek i kryteriów metod analitycznych dla toksyn pochodzenia roślinnego: alkaloidów pirolizydynowych, alkaloidów tropanowych i alkaloidów opium.
Praktyka wykazuje, że już teraz GIS coraz częściej prosi o dostarczenie wyników badań analitycznych surowców takich jak np. ekstrakty z czarnego bzu (Sambucus nigra L.) używane do produkcji suplementów diety, w kierunku zawartości glikozydów cyjanogennych i ich pochodnych w produkcie finalnym.
KONTROLA PODCZAS PANDEMII
Mimo trudnej sytuacji epidemiologicznej w Europie prace KE i EFSA dotyczące bezpieczeństwa żywności stale postępują. Także krajowe organy kontrolne musiały zmierzyć się z nowymi wyzwaniami związanymi z prowadzeniem kontroli i postępowań administracyjnych w dobie epidemii COVID-19. KE stworzyła odpowiednie narzędzia to umożliwiające i zgodnie z art. 3 rozporządzenia wykonawczego Komisji UE 2020/466 kontrole urzędowe i inne czynności urzędowe mogą być w wyjątkowych przypadkach przeprowadzane przez jedną lub kilka osób fizycznych (…), które pozostają w kontakcie z właściwym organem za pomocą dowolnych dostępnych środków łączności [15].
Na zakończenie warto przypomnieć, że od 19.04.2020 r. obowiązują znowelizowane przepisy mające doniosłe znaczenie dla suplementów diety, tj. w zakresie wzajemnego uznawania towarów „mutual recognition”. Rozporządzenie nr 764/2008 zostało zastąpione rozporządzeniem nr 2019/515 z dnia 19 marca 2019 r. w sprawie wzajemnego uznawania towarów zgodnie z prawem wprowadzonych do obrotu w innym państwie członkowskim [12]. Nowe regulacje mają zagwarantować swobodny przepływ towarów, który dotychczas nie był respektowany w wystarczającym stopniu przez poszczególne państwa członkowskie. Tymczasem tylko w uzasadnionych przypadkach można ograniczyć obrót towarem i musi to być adekwatne do celu.
Jednym z wielu przykładów działania tej zasady w praktyce są polskie wymagania dotyczące znakowania żywności „wolnej od GMO”, tj. ustawa z dnia 13 czerwca 2019 r. o oznakowaniu produktów wytworzonych bez wykorzystania organizmów genetycznie zmodyfikowanych jako wolnych od tych organizmów (obowiązująca od 1.01.2020 r.). Zgodnie z art. 2 ust. 2 pkt 1 wspomnianej ustawy do produktów zgodnych przepisami innego państwa członkowskiego i legalnie wprowadzonych na rynek tego państwa ustawa polska nie ma zastosowania. Kwestie dotyczące znakowania produktów bez GMO nie są regulowane przepisami unijnymi, więc w Polsce są przepisem technicznym, który nie może zakłócać swobodnego przepływu towarów w obrębie UE [17].
Zagadnienie swobodnego przepływu produktów jest szczególnie ważne w przypadku suplementów diety – nie tylko z teoretycznego punktu widzenia, ma bowiem też znaczenie praktyczne. Oprócz oznakowania również zakaz stosowania danego składnika albo wyznaczona maksymalna dawka dzienna mogą ograniczać swobodę obrotu produktami.
PODSUMOWANIE:
Wiele wskazuje na dużą potrzebę uregulowania sektora suplementów diety na poziomie wspólnotowym oraz polskim. Zmian należy spodziewać się zarówno w zakresie poziomów składników witaminowo-mineralnych, jak i surowców pochodzenia roślinnego. Komisja Europejska zainicjowała prace nad nowym podejściem do kategorii „botanicals” w ocenie możliwości stosowania tych składników w produkcji żywności oraz dopuszczalnych limitów. Branża niecierpliwie wyczekuje dopuszczenia dodatków technologicznych do stosowania w suplementach dla najmłodszych. Dodatkowo nie można zapomnieć, że w niedalekiej przyszłości Komisja będzie musiała zmierzyć się z rozstrzygnięciem kwestii ponownej oceny deklaracji zdrowotnych (ang. health claims) dotyczących składników botanicznych. 20 maja br. opublikowano draft dokumentu dotyczącego REFIT (ang. Regulatory Fitness and Performance Program) – rozporządzenia (WE) nr 1924/2006 w sprawie oświadczeń żywieniowych i zdrowotnych [1]. Z raportu wynika, że przedłużający się brak uregulowania „claims” z tzw. listy
pending, których ocena przez Urząd ds. Bezpieczeństwa Żywności została wstrzymana, jest niekorzystny zarówno dla konsumentów, jak i przedsiębiorców – w takim przypadku usankcjonowanie przynajmniej części oświadczeń w oparciu o dane dotyczące tradycji stosowania i odrzucenie tych, dla których takich danych nie ma, byłoby dużo bardziej korzystne. Natomiast ujednolicone podejście do możliwości komunikowania konsumentom właściwości składników roślinnych wpłynęłoby korzystnie na funkcjonowanie rynku wewnętrznego UE, poprzez zwiększenie pewności stosowania prawa przez kompetentne organy krajów członkowskich.
Status quo w zakresie składników roślinnych nadal obowiązuje, ale jak długo to potrwa, trudno przewidzieć.
Webinarium Foodie, które odbyło się 27 października 2020 r., było okazją do podsumowania ostatnich zmian prawnych oraz przeglądu perspektyw na najbliższe miesiące.
Prelegentami podczas tego wydarzenia byli znakomici eksperci: pani dr inż. Katarzyna Stoś, prof. nadzw. Narodowego Instytutu Zdrowia Publicznego – Państwowego Zakładu Higieny (NIZP-PZH) i jednocześnie przewodnicząca Zespołu ds. Suplementów Diety GIS, pani Elżbieta Banaś z Instytutu Pomnik Centrum Zdrowia Dziecka, pani Joanna Gajda-Wyrębek NIZP-PZH, a także pani Bożena Pławska z Ministerstwa Rolnictwa i Rozwoju Wsi oraz przedstawiciele Polskiego Związku Producentów Leków Bez Recepty (PASMI), Wojewódzkiej Stacji Sanitarno-Epidemiologicznej w Warszawie, a także ekspert ds. produktów leczniczych, prac Komisji ds. Produktów z Pogranicza w URPL.
Mgr G. Osęka, mgr I. Kowalczyk-Andrzejewska – wspólniczki i doradcy Foodie www.foodie.pl, Warszawa;
e-mail: grazyna.oseka@foodie.pl, iwona.kowalczyk@foodie.pl
LITERATURA:
[1] Commission staff working document evaluation of the regulation (EC) no 1924/2006 on nutrition and health claims made on foods with regard to nutrient profiles and health claims made on plants and their preparations and of the general regulatory framework for their use in foods (023977/EU xxvii. GP Eingelangt am 18/06/20).
[2] Evaluation of the health risks related to the presence of cyanogenic glycosides in foods other than raw apricot kernels, FSA Journal 2019;17 (4): 5662.
[3] https://www.gov.pl/web/gis/elektroniczny-system-powiadomien-powiadomienie-o-wprowadzeniu-po-raz-pierwszy-do-obrotu-suplementy-diety-zywnosc-wzbogacana-zywnosc-dla-okreslonych-grup [dostęp: 1.12.2020].
[4] https://www.gov.pl/web/gis/zespol-do-spraw-suplementow-diety [dostęp: 1.12.2020].
[5] Projekt rozporządzenia Komisji (UE) zmieniającego załącznik III do rozporządzenia (WE) nr 1925/2006 Parlamentu Europejskiego i Rady w odniesieniu do gatunków roślin zawierających pochodne hydro- ksyantracenu.
[6] Projekt rozporządzenia Komisji (UE) zmieniającego rozporządzenie (WE) nr 1881/2006 w odniesieniu do najwyższych dopuszczalnych poziomów alkaloidów pirolizydynowych w niektórych środkach spożywczych.
[7] Projekt ustawy o zmianie niektórych ustaw w związku z promocją prozdrowotnych wyborów konsumentów (wersja z dnia 20 grudnia 2019 r.).
[8] Rozporządzenie Komisji (UE) nr 2020/685 z dnia 20 maja 2020 r. zmieniające rozporządzenie (WE) nr 1881/2006 w odniesieniu do najwyższych dopuszczalnych poziomów nadchloranu w niektórych środkach spożywczych (L 160/3 z 25.5.2020).
[9] Rozporządzenie Komisji (UE) nr 231/2012 z dnia 9 marca 2012 r. ustanawiające specyfikacje dla dodatków do żywności wymienionych w załącznikach II i III do rozporządzenia (WE) nr 1333/2008 Parlamentu Europejskiego i Rady (Tekst mający znaczenie dla EOG) (Dz.U. L 83 z 22.3.2012, s. 1).
[10] Rozporządzenie Ministra Zdrowia z dnia 21 grudnia 2019 r. zmieniające rozporządzenie w sprawie wzoru formularza powiadomienia o produktach wprowadzanych po raz pierwszy do obrotu na terytorium Rzeczypospolitej Polskiej, rejestru produktów objętych powiadomieniem oraz wykazu krajowych jednostek naukowych właściwych do wydawania opinii (Dz.U. z 2019 r., poz. 2499).
[11] Rozporządzenie nr 1925/2006 Parlamentu Europejskiego i Rady z dnia 20 grudnia 2006 r. w sprawie dodawania do żywności witamin i składników mineralnych oraz niektórych innych substancji (L 404/26 z 30.12.2006).
[12] Rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 764/2008 z dnia 9 lipca 2008 r. ustanawiające procedury dotyczące stosowania niektórych krajowych przepisów technicznych do produktów wprowadzonych legalnie do obrotu w innym państwie członkowskim oraz uchylające decyzję nr 3052/95/WE (Dz.U. L 218 z 13.8.2008, s. 2).
[13] Rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 2019/515 z dnia 19 marca 2019 r. w sprawie wzajemnego uznawania towarów zgodnie z prawem wprowadzonych do obrotu w innym państwie członkowskim oraz uchylające rozporządzenie (WE) nr 764/2008 (L 91/1 z 29.3.2019).
[14] Rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 1333/2008 z dnia 16 grudnia 2008 r. w sprawie dodatków do żywności (Tekst mający znaczenie dla EOG) (Dz.U. L 354 z 31.12.2008, s. 16).
[15] Rozporządzenie Wykonawcze Komisji (UE) nr 2020/466 z dnia 30 marca 2020 r. w sprawie środków tymczasowych mających na celu ograniczenie ryzyka dla zdrowia ludzi, zwierząt i roślin oraz dobrostanu zwierząt podczas określonych poważnych zakłóceń w systemach kontroli państw członkowskich z powodu choroby koronawirusowej (COVID-19) (L 98/30 z 31.3.2020).
[16] Ustawa z dnia 14 marca 1985 r. o Państwowej Inspekcji Sanitarnej (Dz.U. 1985 nr 12 poz. 49, ost. zm. z 2020 r. poz. 322, 374, 567, 1337).
[17] Ustawa z dnia 13 czerwca 2019 r. o oznakowaniu produktów wytworzonych bez wykorzystania organizmów genetycznie zmodyfikowanych jako wolnych od tych organizmów (Dz.U. 2019
poz. 1401).
[18] Ustawa z dnia 25 sierpnia 2006 r. o bezpieczeństwie żywności i żywienia (tj. Dz.U. z 2020 r. poz. 2021).