DOI
Sylwia Sady
Maria Sielicka-Różyńska
| STRESZCZENIE: |
| Spośród pseudozbóż, czyli grupy roślin niebędących zbożami, ale przypominającymi je ze względu na wygląd, skład chemiczny nasion oraz podobne zastosowania przemysłowe, szczególne miejsce zajmują canihua i komosa ryżowa. W artykule dokonano porównania wybranych właściwości prozdrowotnych nasion jednej odmiany canihua oraz trzech odmian komosy ryżowej. Badane nasiona charakteryzują się wysoką pojemnością przeciwutleniającą i znaczną zawartością związków fenolowych, przy czym dwukrotnie wyższą aktywność przeciwrodnikową i siłę redukującą wykazała canihua. Nasiona canihua i komosy ryżowej są cennym źródłem tłuszczu o korzystnym składzie kwasów tłuszczowych, gdyż zawierają 53,5-63,1% wielonienasyconych kwasów tłuszczowych. Canihua w porównaniu z komosą ryżową zawiera istotnie wyższą ilość wapnia oraz mikroelementów, takich jak żelazo, mangan, cynk i miedź. Nie stwierdzono istotnego wpływu badanych odmian komosy ryżowej na właściwości prozdrowotne. |
| SUMMARY: |
| Among pseudo-cereals, i.e. a group of plants that are not cereal grains, but resemble them in appearance, chemical composition and similar industrial applications, canihua and quinoa occupy a special place. The article compares selected health-promoting properties of grains of one variety of canihua and three varieties of quinoa. The grains exhibited high antioxidant capacity and a significant amount of phenolic compounds, quinoa canihua showed twofold higher antiradical and reducing activity. Canihua and quinoa grains are a valuable source of oils with a favourable fatty acid composition, as they contain 53.5-63.1% of polyunsaturated fatty acids. Canihua, in comparison to quinoa, has a significantly higher content of calcium and micronutrients such as iron, manganese, zinc and copper. There was no significant effect of quinoa varieties on the health-promoting properties. TITLE: Canihua And Quinoa – The Comparison of Health-Promoting Properties of Gluten-Free Pseudocereals |
SŁOWA KLUCZOWE:
pseudozboża, canihua, komosa ryżowa, aktywność przeciwutleniająca, bez glutenu
KEY WORDS:
pseudocereals, canihua, quinoa, antioxidant activity, gluten-free
W ostatnich latach poszukuje się wartościowych zamienników tradycyjnych zbóż, dlatego też pseudozboża, stanowiące grupę roślin, które nie należą do rodziny traw, ale wytwarzają nasiona przypominające w składzie ziarniaki zbóż, cieszą się coraz większym zainteresowaniem wśród producentów żywności oraz konsumentów [22]. Stanowią one cenny produkt dla osób chorych na celiakię oraz nietolerancję glutenu, gdyż nie zawierają białek glutenowych, a ponadto są bogatym źródłem niezbędnych nienasyconych kwasów tłuszczowych, składników mineralnych i witamin oraz pełnowartościowego białka, które przewyższa pod względem jakościowym białka pochodzące od zbóż chlebowych [7].
Komosa ryżowa, inaczej quinoa (Chenopodium quinoa Willd.), była pierwotnie uprawiana w regionie Andów, głównie na terenie Peru i Boliwii, a obecnie jej uprawa rozprzestrzeniła się na inne kontynenty. W roku 2000 światowa produkcja komosy ryżowej wynosiła 52 600 t, natomiast w roku 2019 była ponad trzykrotnie wyższa, osiągając wartość 161 400 t [30]. Dużo mniej poznanym pseudozbożem i nadal mało popularnym w Polsce, również należącym do rodziny szarłatowatych, jest canihua (Chenopodium pallidicaule Allen), zwana także cañahua lub kañiwa. Uprawiana jest na płaskowyżu Altiplano na terenie Peru i Boliwii, na wysokości 3600 do 4300 m n.p.m. [23]. Komosa ryżowa i canihua przystosowują się do niemal każdych warunków klimatycznych; można je uprawiać na terenach górzystych, jak i na nizinach, w miejscach objętych suszą oraz o wysokim zasoleniu. Dlatego uważane są za uprawy strategiczne mogące zapewnić bezpieczeństwo żywnościowe w krajach doświadczających problemów z wyżywieniem ludności [3, 18, 28]. Canihua, w porównaniu z komosą ryżową, rośnie i dojrzewa szybciej. Nasiona obu gatunków mają płaski, owalny kształt o barwie od białej po czarną, często żółtą lub czerwoną. Nasiona canihua mają średnicę około 1 mm i są o połowę mniejsze niż nasiona komosy ryżowej [23]. W porównaniu z większością zbóż, charakteryzują się wyższą zawartością białka i tłuszczu, a niższą zawartością węglowodanów [11, 19]. Białko tych roślin ma wysoką jakość, gdyż jest bogate w aminokwasy egzogenne, w szczególności aminokwasy zawierające siarkę, aminokwasy aromatyczne i lizynę, które występują w ilościach wyższych niż zalecane przez FAO-WHO jako niezbędne do prawidłowego odżywiania ludzi [28]. Skład chemiczny nasion uzależniony jest od odmiany, jednak badania potwierdzają wyższą zawartość białka (średnio 15,2%) oraz błonnika (średnio 7,9%) w nasionach canihua niż komosy ryżowej (odpowiednio 12,6% oraz 3%) [22]. Komosa ryżowa zawiera znaczne ilości saponin (0,1-5%), zlokalizowanych głównie w zewnętrznej warstwie nasion (łusce), które nadają ziarnom nieprzyjemny gorzki smak. W celu redukcji saponin najczęściej stosuje się wymywanie lub ścieranie mechaniczne przed dalszą obróbką [9, 15]. Z kolei canihua zawiera niewielką ilość saponin, nie powodując gorzkiego smaku produktu [6, 21].
Z uwagi na wysoką wartość żywieniową komosy ryżowej Zgromadzenie Ogólne ONZ ogłosiło rok 2013 „Międzynarodowym Rokiem Komosy Ryżowej” w celu podkreślenia znaczenia komosy ryżowej dla różnorodności biologicznej oraz dla gospodarek krajów w różnych regionach świata, a także zwiększania popytu na to pseudozboże [18]. Nasiona komosy ryżowej mają wiele zastosowań – suszone stosowane są w sałatkach i musli, gotowane jako dodatek do dań, ekstrudowane w płatkach śniadaniowych, a mielone na mąkę wykorzystywane przy wypieku pieczywa oraz tortilli. Ponadto nasiona komosy ryżowej mogą być fermentowane i używane do produkcji piwa lub południowoamerykańskiego tradycyjnego napoju „chichi” [11, 14]. Nasiona canihua są najczęściej prażone, w celu uzyskania mąki o orzechowej nucie (kañiwaco), która z kolei mieszana jest wodą lub mlekiem i spożywana na śniadanie. Zmielone nasiona canihua mogą być stosowane do przygotowania chleba, makaronu, słodyczy, przekąsek oraz w mieszankach mlekozastępczych dla niemowląt [21].
Rosnące zainteresowanie zamiennikami tradycyjnych zbóż, udokumentowane cenne właściwości żywieniowe komosy ryżowej i canihua, oraz liczne odmiany komosy ryżowej to czynniki, które stały się podstawą do przeprowadzenia badań porównawczych nasion jednej odmiany canihua oraz trzech odmian komosy ryżowej pod kątem ich właściwości prozdrowotnych. W ramach pracy oznaczono pojemność przeciwutleniającą pseudozbóż, zawartość związków fenolowych, zawartość tłuszczu, skład kwasów tłuszczowych oraz zawartość wybranych mikro- i makroelementów.
MATERIAŁ I METODY
Materiał do badań stanowiły ekologiczne nasiona canihua, komosy ryżowej białej, komosy ryżowej czerwonej oraz komosy ryżowej czarnej, dostępne komercyjnie (rysunek 1).

Rys. 1. Nasiona canihua (A) oraz trzech odmian komosy ryżowej: białej (B), czerwonej (C) i czarnej (D)
Fig. 1. Canihua seeds (A) and three varieties of quinoa: white (B), red (C) and black (D)
Zmielone nasiona (5 g) poddano trzykrotnej ekstrakcji (3 x 15 minut), stosując 25 cm3 70% roztworu alkoholu metylowego. Ekstrakcję przeprowadzono w temperaturze 40°C w łaźni ultradźwiękowej (Sonic-6, 40 kHz, 240 W). Otrzymane ekstrakty przesączono na lejku Büchnera, a następnie łączono i zagęszczano pod zmniejszonym ciśnieniem. Zatężone ekstrakty przeniesiono do kolb miarowych o pojemności 25 cm3 i uzupełniono 70% alkoholem metylowym. Przygotowane ekstrakty przechowywano w temperaturze –20°C do czasu wykonania poszczególnych analiz. W uzyskanych ekstraktach oznaczono aktywność przeciwrodnikową zmierzoną za pomocą testu DPPH, siłę redukującą przy użyciu testu FRAP oraz ogólną zawartość związków fenolowych.
Badanie właściwości przeciwrodnikowych nasion przeprowadzono według metody Sanchez-Moreno i in. [24] z modyfikacją polegającą na ustaleniu częstotliwości pomiarów i zakresu stężeń próbki w badanym układzie oraz użyciu metanolowego roztworu rodnika DPPH (2,2-difenylo-1-pikrylohydrazylu). Do kolbki miarowej odważono 0,0025 g rodnika DPPH i rozpuszczono w 100 cm3 96% alkoholu metylowego. Do analizy pobrano 2,4 cm3 roztworu rodnika i 0,1 cm3 próbki. Pomiar absorbancji próbek wykonywano przez 10 minut co pół minuty przy długości fali 515 nm. W procedurze analitycznej zastosowano odnośnik, który wykonano analogicznie, dodając zamiast próbki wodę destylowaną. Obliczono redukcję rodnika DPPH po 10 minutach inkubacji próbki. Aktywność przeciwrodnikową nasion wyznaczono na podstawie krzywej wzorcowej i wyrażono w μmolach troloksu w 100 g nasion.
Siłę redukującą badanych ekstraktów oceniono za pomocą testu FRAP (ang. Ferric Reducing Antioxidant Power) w oparciu o metodykę Benzie i Strain [5]. Do oznaczenia siły redukującej sporządzono mieszaninę reakcyjną zawierającą 10 mmol/dm3 roztworu TPTZ (2,4,6-tripirydylo-S-tiazyny) w 40 mmol/dm3 HCl, 20 mmol/dm3 FeCl3, 0,1 mol/dm3 buforu octowego (pH=3,6) w stosunku objętościowym 1:1:10. Do analizy pobrano 0,3 cm3 ekstraktu, 2 cm3 mieszaniny reakcyjnej i uzupełniono wodą destylowaną do 10 cm3. Próbki wytrząsano przez 5 sekund, po czym pozostawiono na 8 minut w temperaturze pokojowej. Następnie dokonywano pomiaru absorbancji. Siłę redukującą nasion wyznaczono na podstawie krzywej wzorcowej i wyrażono w μmolach troloksu w 100 g nasion.
Oznaczenie ogólnej zawartości związków fenolowych przeprowadzono przy użyciu metody spektrofotometrycznej [26]. Do kolb miarowych (10 cm3) pobrano kolejno: 5 cm3 wody destylowanej, 0,5 cm3 odczynnika Folina-Ciocalteu oraz 0,1 cm3 próbki. Po 3 minutach inkubacji w temperaturze pokojowej do kolb dodano 1,5 cm3 20% roztworu węglanu sodu i uzupełniono wodą destylowaną do kreski. Po upływie 2 godzin wykonywano pomiar absorbancji przy długości fali 725 nm. Zastosowany odnośnik przygotowano analogicznie, dodając zamiast próbki wodę. Zawartość związków fenolowych w nasionach wyznaczono na podstawie krzywej wzorcowej i wyrażono w mg kwasu galusowego (GAE) w 100 g nasion.
Oznaczenie zawartości tłuszczu wykonano w aparacie ekstrakcyjnym SER 148/3 (VELP Scientifica). Gilzy ekstrakcyjne napełniono 5 g zmielonych nasion. Ekstrakcję przeprowadzono w oparciu o technikę Randalla z 3 głównymi fazami [12]. W pierwszej fazie (zanurzenie ekstrakcyjne) próbkę zanurzono na 60 minut w heksanie przy temperaturze płyty grzejnej wynoszącej 145°C. Następnie próbkę przemywano przez 60 minut w tym samym rozpuszczalniku (ekstrakcja do nawrotu). Na koniec odzyskiwano rozpuszczalnik przez 90 minut, a kubki ekstrakcyjne z tłuszczem ważono. Zawartość tłuszczu w nasionach wyrażono w procentach.
Analizę składu kwasów tłuszczowych w tłuszczu wyekstrahowanym z nasion przeprowadzano przy użyciu chromatografu gazowego Agilent 7820A Series II zgodnie z metodyką opisaną przez Wąsowicza i Kamińskiego [29]. Jako substancje wzorcowe do analizy jakościowej wykorzystano standardową mieszaninę estrów metylowych kwasów tłuszczowych. Analizę ilościową przeprowadzono metodą normalizacji wewnętrznej, polegającej na ustaleniu procentowego udziału składników w mieszaninie.
Do określenia zawartości składników mineralnych zastosowano spektrometrię emisyjną z plazmą indukowaną mikrofalami (MP-AES) po uprzedniej mineralizacji próbek. Do mineralizacji pobrano około 0,5 g każdej próbki i przeniesiono do naczynia teflonowego. Następnie dodano 7 cm3 HNO3 (65%) i 1 cm3 H2O2 (30%) [27]. Mineralizację przeprowadzono w temperaturze 210°C przez 2 godziny. Po schłodzeniu hydrolizaty rozcieńczono do 25 cm3 wodą zdemineralizowaną. Stężenia minerałów oznaczono zgodnie z metodą opisaną przez Ozbeka i Akman [16]. Dla każdego oznaczenia sporządzono co najmniej dwie krzywe kalibracji, które dostosowano do oczekiwanego stężenia w analizowanej próbce. Zawartość składników mineralnych w nasionach wyrażono w mg na 100 g nasion.
Prezentowane wyniki badań analitycznych stanowią średnią arytmetyczną co najmniej trzech równoległych oznaczeń. Dla zweryfikowania istotności różnic pomiędzy wartościami średnimi zastosowano analizę wariancji ANOVA z testem posthoc (test Tukey’a), posługując się programem komputerowym Statistica 13.0. W szacowaniu statystycznym za poziom istotności przyjęto p<0,05.
WYNIKI I ICH OMÓWIENIE
Ocenę pojemności przeciwutleniającej nasion canihua, komosy ryżowej białej, czerwonej oraz czarnej przeprowadzono na podstawie określenia aktywności przeciwrodnikowej (test z rodnikiem DPPH) i siły redukującej (test FRAP), a wyniki zaprezentowano na rysunku 2.
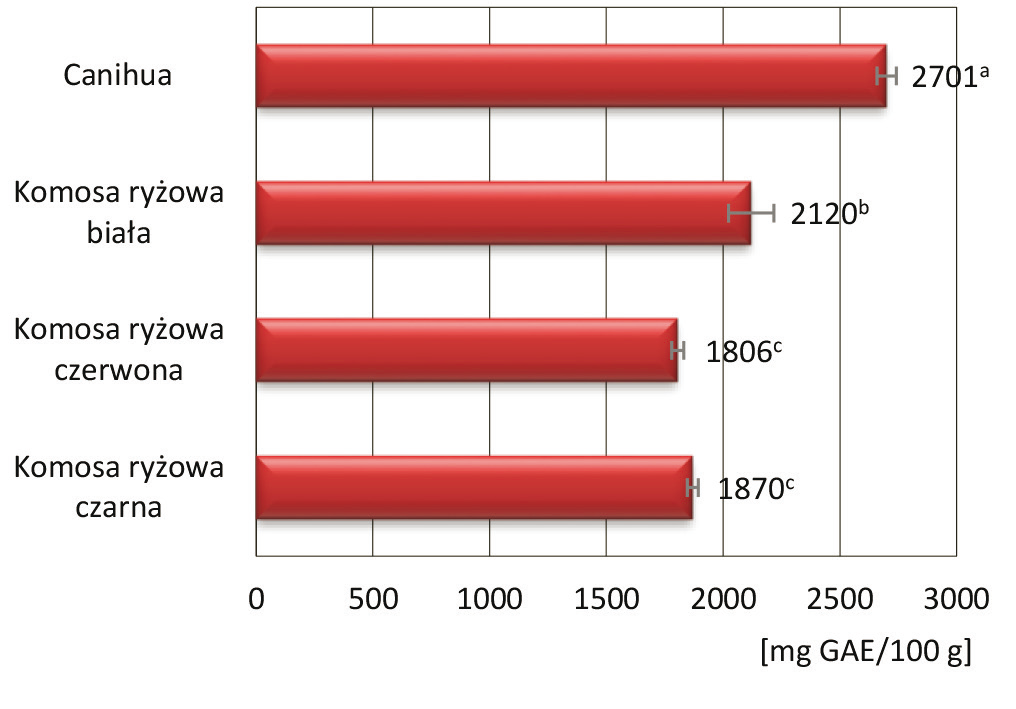
Rys. 2. Ocena pojemności przeciwutleniającej nasion canihua i komosy ryżowej
Fig. 2. Assessment of the antioxidant capacity of canihua and quinoa seeds
Test z zastosowaniem rodnika DPPH wykazał, że najsilniejszymi właściwościami przeciwrodnikowymi charakteryzowały się nasiona canihua (1136 μmol troloksu na 100 g nasion), dwukrotnie wyższymi niż nasiona komosy ryżowej. Zaobserwowano nieznaczne, nieistotnie statystycznie różnice między aktywnością przeciwrodnikową trzech gatunków nasion komosy, w zakresie od 436 μmol troloksu na 100 g nasion dla komosy czarnej do 464 μmol troloksu na 100 g nasion dla komosy białej. Badane próbki wykazały duże zróżnicowanie pod względem siły redukującej, przy czym najwyższą charakteryzowały się nasiona canihua (1148 μmol troloksu na 100 g nasion). Spośród nasion komosy ryżowej wysoki potencjał redukujący wykazały nasiona komosy ryżowej czarnej (696 μmol troloksu na 100 g nasion).
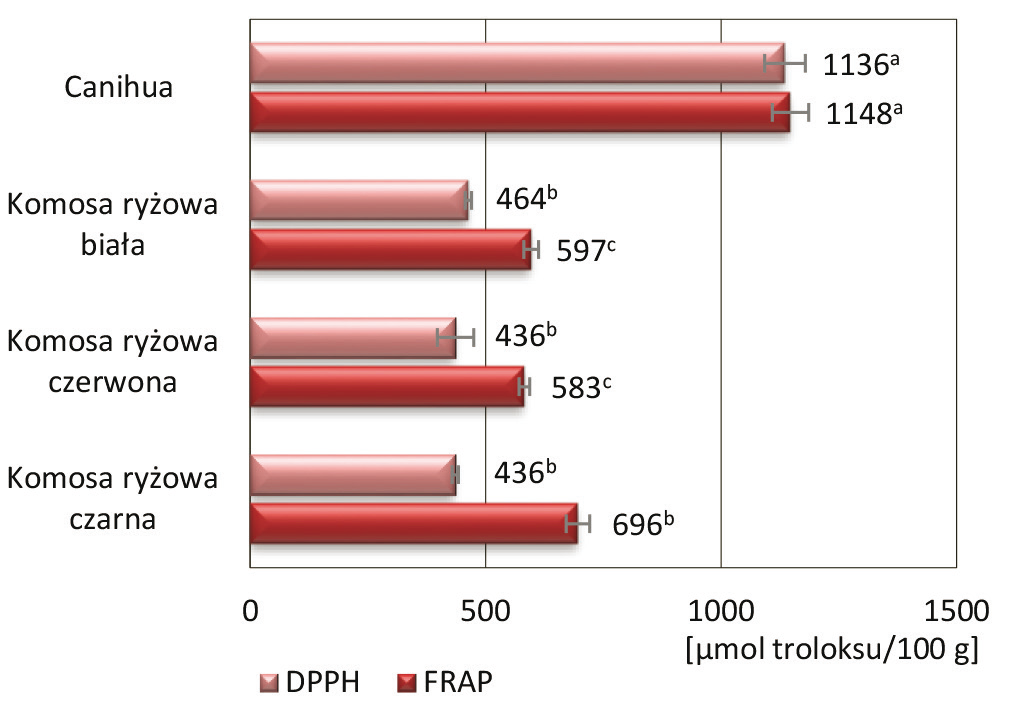
Rys. 3. Ogólna zawartość związków fenolowych w nasionach canihua i komosy ryżowej
Fig. 3. The total content of phenolic compounds in canihua and quinoa seeds
Spośród badanych nasion istotnie najwyższą ogólną zawartością związków fenolowych oznaczały się nasiona canihua (2701 mg GAE w 100 g nasion), a następnie komosa ryżowa biała (2120 mg GAE w 100 g nasion). Zawartość związków fenolowych w nasionach komosy ryżowej czarnej i czerwonej były na zbliżonym poziomie, odpowiednio 1870 mg i 1806 mg GAE na 100 g nasion (rysunek 3). Abderrahim i in. [1] przeprowadzili badania polegające na ocenie wpływu barwy różnych nasion komosy ryżowej na ogólną zawartość związków fenolowych. Zaobserwowali, że im ciemniejsza barwa nasion, tym ogólna zawartość związków fenolowych jest wyższa. Nasze badania nie potwierdziły takiej zależności, co z kolei zgodne jest z wynikami Diaz-Valencia i in. [8], którzy najniższą zawartość związków fenolowych odnotowali w przypadku nasion komosy ryżowej czarnej.
Według źródeł literaturowych nasiona canihua i komosy ryżowej są dobrym źródłem związków fenolowych [11, 14, 22]. Peñarrieta i współautorzy [17] oznaczyli w nasionach canihua osiem związków fenolowych zidentyfikowanych jako galusan katechiny, katechinę, kwas wanilinowy, kemferol, kwas ferulowy, kwercetynę, rezorcynol i 4-metylorezorcynol. Zhu i in. [31] wyizolowali z nasion komosy ryżowej sześć flawonoidów w formie glikozylowanej i zasugerowali, że komosa ryżowa może stanowić ważne źródło związków skutecznych do hamowania rodników. Kwercetyna i kemferol to najczęściej występujące związki fenolowe w komosie ryżowej [22].
W technologii żywności obserwuje się tendencję poszukiwania alternatywnych źródeł tłuszczu o znacznej zawartości niezbędnych nienasyconych kwasów tłuszczowych cennych pod względem żywieniowym, jak również dietetycznym oraz leczniczym. Zawartość tłuszczu oraz skład kwasów tłuszczowych w nasionach canihua i komosy ryżowej przedstawiono w tabeli 1. Nasiona canihua i komosy ryżowej są bogatym źródłem tłuszczu w stosunku do pszenicy, kukurydzy, żyta i ryżu [28]. Badane nasiona zawierały od 5,4% dla komosy ryżowej czarnej do 8,2% tłuszczu dla nasion canihua. Z kolei, Villa i współautorzy [28] oznaczyli wyższą zawartość tłuszczu w nasionach komosy ryżowej (12,4%) niż w nasionach canihua (7,0%). Oznaczone zawartości tłuszczu w komosie ryżowej są zgodne z danymi wskazanymi w pracach Ahmeda i in. [3] oraz Achremowicza i in. [2].
Tabela 1. Zawartość tłuszczu i skład kwasów tłuszczowych w nasionach canihua i komosy ryżowej [%]
Table 1. Fat content and fatty acid composition in canihua and quinoa grains [%]
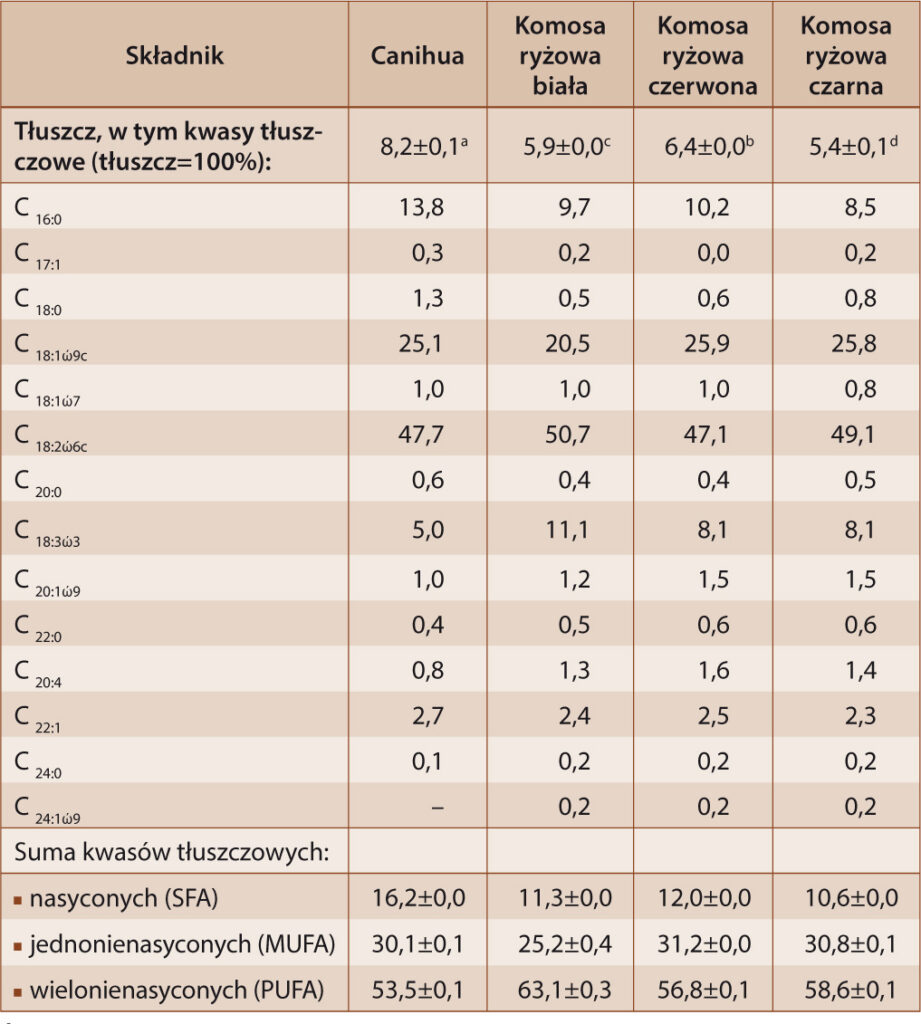
Objaśnienia: *wyniki podane jako wartość średnia ± odchylenie standardowe; a, d – wartości średnie oznaczone tymi samymi literami nie różnią się statystycznie istotnie (p<0,05).
Wśród 14 zidentyfikowanych kwasów tłuszczowych w trzech odmian komosy ryżowej i 13 zidentyfikowanych kwasów tłuszczowych dla canihua dominował kwas linolowy. Udział kwasu linolowego w sumie kwasów tłuszczowych wszystkich badanych nasion był porównywalny i wynosił od 47,1% do 50,7%. Kwas linolowy zalicza się do niezbędnych nienasyconych kwasów tłuszczowych i jest uważany za najważniejszy ze wszystkich kwasów omega-6, których organizm ludzki nie syntetyzuje z powodu braku odpowiednich enzymów. W znacznych ilościach występowały również kwasy oleinowy i linolenowy. Kwas oleinowy oznaczono na poziomie od 20,5% dla nasion komosy ryżowej białej do 25,9% dla komosy ryżowej czerwonej, natomiast kwas linolenowy oznaczono na poziomie od 5,0% dla nasion canihua do 11,1% dla nasion komosy ryżowej białej. Repo-Carrasco-Valencia [20] podaje, że zawartość kwasu oleinowego w nasionach komosy ryżowej może kształtować się od 24,5% do 26,7%, natomiast zawartość kwasu linolenowego może wynieść od 3,9% do 8,3%. Z kolei dla nasion canihua zawartość kwasu oleinowego została odnotowana na poziomie 23,5%, a dla kwasu linolenowego – 6,0%. Taki skład kwasów tłuszczowych sprawia, że spożywanie nasion canihua i komosy ryżowej lub produktów z nich otrzymanych może sprzyjać obniżaniu poziomu cholesterolu, wspomagać pracę układu krążenia i zmniejszać ryzyko miażdżycy [2]. Nasiona charakteryzowały się wysokim udziałem nienasyconych kwasów tłuszczowych (od 83,6% w przypadku nasion canihua do 89,4% w przypadku komosy ryżowej czarnej), przy czym 53,5-63,1% stanowiły wielonienasycone kwasy tłuszczowe. Należy zwrócić także uwagę na stosunkowo niski udział nasyconych kwasów tłuszczowych w ogólnej ilości kwasów tłuszczowych.
Składniki mineralne ze względu na zapotrzebowanie organizmu dzieli się na dwie podstawowe grupy: makroelementy (ponad 100 mg/dobę) i mikroelementy (poniżej 100 mg/dobę). Zawartość wybranych pierwiastków w badanych nasionach przedstawiono w tabeli 2.
Tabela 2. Zawartość składników mineralnych w nasionach canihua i komosy ryżowej [mg/100 g]
Table 2. The content of minerals in canihua and quinoa grains [mg / 100 g]
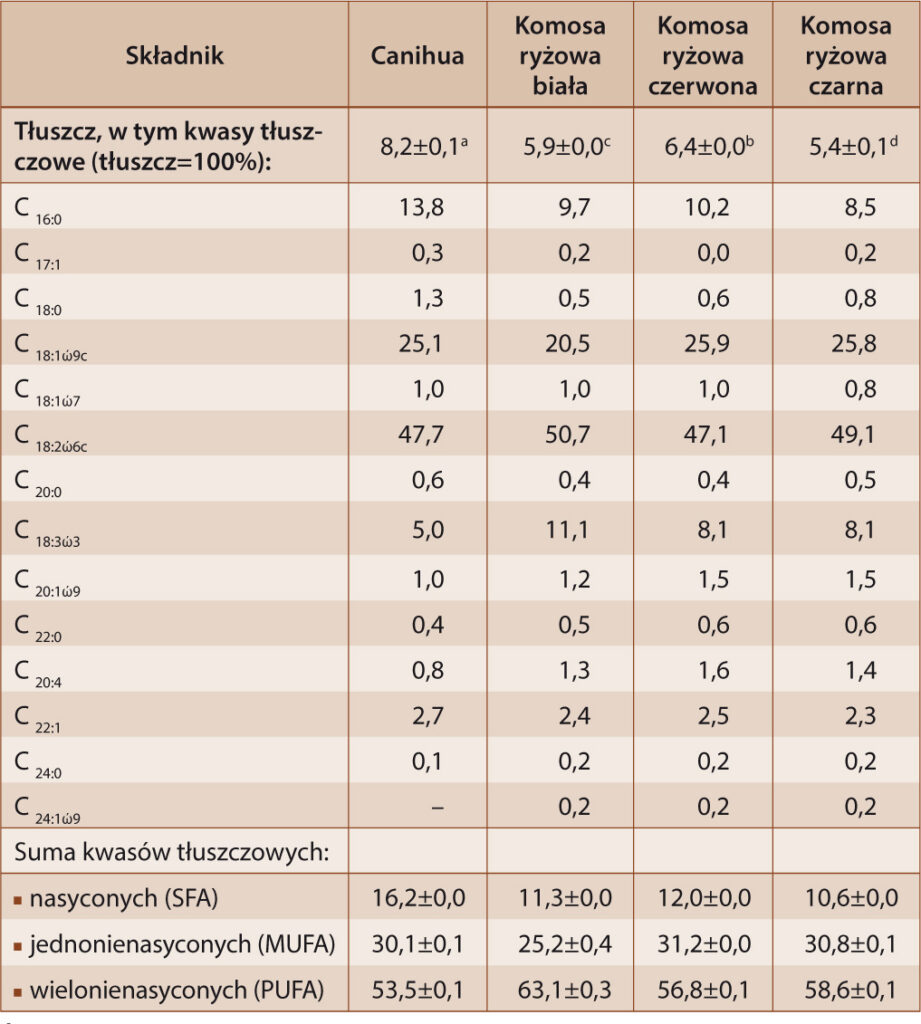
Objaśnienia: *RWS – Referencyjna Wartość Spożycia dla Ca, Fe, Mg, Mn, Zn i Cu; AI – wystarczające spożycie dla Na, K (zgodne z wytycznymi EFSA); **wyniki podane jako wartość średnia ± odchylenie standardowe; a, b, c, – wartości średnie oznaczone tymi samymi literami nie różnią się statystycznie istotnie (p<0,05); ***<LOD – poniżej limitu wykrywalności.
Na podstawie przeprowadzonych badań stwierdzono, że w badanych nasionach w największych ilościach znajdował się potas – od 603,0 mg (canihua) do 853,5 mg (komosa ryżowa czarna) w 100 g nasion. Inni autorzy również podkreślali wysoką (powyżej 700,0 mg/100 g) zawartość tego pierwiastka w nasionach komosy ryżowej [10, 25]. Analizowane nasiona zawierały od 160,5 mg do 203,5 mg magnezu, przy czym nie stwierdzono istotnie statystycznych różnic zawartości. Nasiona canihua charakteryzowała się ponad dwukrotnie wyższą zawartością wapnia (91,5 mg/100 g) w stosunku do analizowanych nasion komosy ryżowej (około 40 mg/100 g). Wapń ma istotny udział w krzepnięciu krwi, skurczu mięśni szkieletowych, gładkich oraz mięśnia sercowego, wpływa także na przepuszczalność naczyń krwionośnych i błon komórkowych. Według Konishi i in. [13] proces usuwania saponin z nasion komosy ryżowej może obniżyć zawartość wapnia, ponieważ ten minerał jest bardziej skoncentrowany w owocni, a następnie w zarodku i okołospermie. Tylko dla nasion canihua (8,5 mg/100 g) i komosy ryżowej białej (2,2 mg/100 g) oznaczono zawartość sodu powyżej limitu wykrywalności. Najwyższymi zawartościami wszystkich czterech badanych mikroelementów charakteryzowały się nasiona canihua, dla których w 100 g oznaczono 12,6 mg żelaza, 6,2 mg manganu, 3,6 mg cynku i 0,6 mg miedzi. Dla nasion komosy ryżowej zawartość żelaza kształtowała się między 3,9 mg/100 g (komosa ryżowa czerwona) a 4,5 mg/100 g (komosa ryżowa czarna). Nieco wyższy poziom zawartości tego pierwiastka (5,5 mg) oznaczyli w swoich badaniach Alvarez-Jubetei i współautorzy [4]. Żelazo jako składnik hemoglobiny uczestniczy w transporcie tlenu do komórek i tkanek organizmu, ponadto jest niezbędne do prawidłowej aktywności wielu enzymów, a także wspomaga metabolizm. Spośród 3 analizowanych odmian komosy ryżowej najwyższą zawartość manganu oznaczono dla komosy ryżowej czerwonej (4,1 mg/100 g), cynku dla komosy ryżowej białej (3,5 mg/100 g), a miedzi dla komosy ryżowej czarnej (0,3 mg/100 g).
PODSUMOWANIE:
Chęć zapewnienia „wellbeingu” oraz profilaktyka zdrowotna zachęcają konsumentów oraz producentów żywności do poszukiwania alternatywnych składników diety o działaniu prozdrowotnym. Niejednokrotnie powraca się do tradycyjnych, ludowych lub lokalnych surowców nadając im nowe zastosowania oraz rozpowszechniając w innych obszarach. Przykładem takich surowców są popularna komosa ryżowa oraz dużo mniej poznana canihua. Nasiona tych pseudozbóż wykazują silne właściwości przeciwutleniające, będąc źródłem związków fenolowych. Wysoka zawartość nienasyconych kwasów tłuszczowych oraz znaczna zawartość składników mineralnych stwarza możliwość ich szerokiego wykorzystania w różnych produktach, suplementach diety, a z uwagi na brak glutenu mogą być stosowane przez osoby na dietach eliminacyjnych z nietolerancją lub alergią na ten składnik. Na szczególną uwagę zasługują nasiona canihua, które w przeprowadzonych badaniach in vitro w zestawieniu z nasionami komosy ryżowej, okazały się wykazywać niejednokrotnie wyższe właściwości prozdrowotne.
Mgr inż. S. Sady (ORCID: 0000-0002-4744-9361), dr inż. M. Sielicka-Różyńska (ORCID: 0000-0002-5477-3311) – Studenckie Koło Naukowe Towaroznawstwa Żywności „Spectrum”, Katedra Jakości i Bezpieczeństwa Żywności, Instytut Nauk o Jakości, Uniwersytet Ekonomiczny w Poznaniu;
e-mail: maria.sielicka@ue.poznan.pl
LITERATURA:
[1] Abderrahim F., E. Huanatico, R. Segura, S. Arribas , M.C. Gonzales, L. Condezo-Hoyos. 2015. „Physical features, phenolic compounds, betalains and total antioxidant capacity of coloured quinoa seeds (Chenopodium quinoa Willd.) from Peruvian Altiplano”. Food Chemistry 183: 83-90. DOI: 10.1016/j.foodchem.2015.03.029.
[2] Achremowicz B., A. Ceglińska, M. Darmetko, T. Haber, P. Karpiński, M. Obiedziński, M. Truszkowska. 2016. „Ogólna charakterystyka komosy ryżowej oraz możliwości jej wykorzystania w przetwórstwie żywności”. Postępy Techniki Przetwórstwa Spożywczego 1 : 68-77.
[3] Ahmed I.A. M., Juhaimi F. A., Ozcan M. M. 2021. „Insights into the nutritional value and bioactive properties of quinoa (Chenopodium quinoa): past, present and future prospective”. International Journal of Food Science and Technology. DOI 10.1111/ijfs.15011.
[4] Alvarez-Jubete L., E.K. Arendt, E. Gallagher. 2009. „Nutritive value and chemical composition of pseudocereals as gluten-free ingredients”. International Journal of Food Sciences and Nutrition 60 (S4) : 240-257. DOI: 10.1080/09637480902950597.
[5] Benzie I.F.F., J.J. Strain. 1996. „The ferric reducing ability of plasma (FRAP) as a measure of «antioxidant power»: The FRAP assay”. Analytical Biochemistry 239 : 70-76.
[6] Betalleluz-Pallardel I., I. Marianela, L. Mera, R. Pedreschi, D. Campos, R. Chirinos. 2017. „Optimisation of extraction conditions and thermal properties of protein from the Andean pseudocereal canihua (Chenopodium pallidicaule Aellen)”. International Journal of Food Science and Technology 52 : 1026-1034. DOI:10.1111/ijfs.13368
[7] Castro-Alba V., C.E. Lazarte, D. Perez-Rea, N.G. Carlsson, A. Almgren, B. Bergenståhl, Y. Granfeldt. 2019. „Fermentation of pseudocereals quinoa, canihua, and amaranth to improve mineral accessibility through degradation of phytate”. Journal of the science of food and agriculture 99 (11) : 5239-5248. DOI: 1002/jsfa.9793.
[8] Diaz-Valencia Y.K.., J.J. Alca, M.A. Calori-Domingues, S.J. Zanabria-Galvez, S.H. Da Cruz. 2018. „Nutritional composition, total phenolic compounds and antioxidant activity of quinoa (Chenopodium quinoa Willd.) of different colours”. Nova Biotechnologica Et Chimica 17 (1) : 74-85. DOI: 10.2478/nbec-2018-0008.
[9] Filho A.M., M.R. Pirozi, J.T. Borges, H.M. Pinheiro Sant’Ana, J.B. Chaves, J.S. Coimbra. 2017. „Quinoa: Nutritional, functional, and antinutritional aspects”. Critical Reviews in Food Science and Nutrition 57 (8) : 1618-1630. DOI: 10.1080/10408398.2014.1001811.
[10] Gordillo-Bastidas E., D.A. Diaz-Rizzolo, E. Roura, T. Massanes, R. Gomis. 2016. „Quinoa (Chenopodium quinoa Willd), from nutritional value to potential health benefits: An integrative review”. Journal of Nutrition & Food Sciences 6. DOI: 10.4172/2155-9600.1000497.
[11] Graf B.L., P. Rojas-Silva, L.E. Rojo, J. Delatorre-Herrera, M.E. Baldeon, I. Raskin. 2015. „Innovations in Health Value and Functional Food Development of Quinoa (Chenopodium quinoa Willd.)”. Comprehensive Reviews in Food Science and Food Safety 14 : 431-445. DOI: 10.1111/1541-4337.12135.
[12] Guidotti M., C. Protano, C. Dominici, S. Chiavarini, N. Cimino, M. Vitali. 2013. „Determination of selected polychlorinated dibenzo-p-dioxins/furans in marine sediments by the application of gas-chromatography-triple quadrupole mass spectrometry”. Bulletin of Environmental Contamination and Toxicology 90 : 525-530. DOI: 10.1007/s00128-012-0956-5.
[13] Konishi Y., S. Hirano, H. Tsuboi, M. Wada . 2004. „Distribution of minerals in quinoa (Chenopodium quinoa Willd.) seeds”. Bioscience, Biotechnology, and Biochemistry 68 (1) : 231-234. DOI: 10.1271/bbb.68.231.
[14] Li L., G. Lietz, C.J. Seal. 2021. „Phenolic, apparent antioxidant and nutritional composition of quinoa (Chenopodium quinoa Willd.) seeds”. International Journal of Food Science and Technology. DOI: 10.1111/ijfs.14962.
[15] Lim J.G., H.M. Park, K.S. Yoon. 2020. „Analysis of saponin composition and comparison of the antioxidant activity of various parts of the quinoa plant (Chenopodium quinoa Willd.)”. Food Science and Nutrition 8 (1) : 694-702. DOI: 10.1002/fsn3.1358.
[16] Ozbek N., S. Akman. 2016. „Method development for the determination of calcium, copper, magnesium, manganese, iron, potassium, phosphorus and zinc in different types of breads by microwave induced plasma atomic emission spectrometry”. Food Chemistry 200 (1) : 245-248.
[17] Peñarrieta J.M., J. A. Alvarado, B. Åkesson, B. Bergenståhl. 2008. „Total antioxidant capacity and content of flavonoids and other phenolic compounds in canihua (Chenopodium pallidicaule): An Andean pseudocereal”. Molecular Nutrition & Food Research 52 (6) : 708-717. DOI:10.1002/mnfr.200700189.
[18] Quinoa: An ancient crop to contribute to world food security. 2011. Technical Raport. Regional Office for Latin America and the Caribbean.
[19] Repo-Carrasco R., C. Espinoza, S.-E. Jacobsen. 2003. „Nutritional value and use of the Andean crops Quinoa (Chenopodium quinoa) and Kañiwa (Chenopodium pallidicaule)”. Food Reviews International 19 (1-2) : 179-189. DOI: 10.1081/FRI-120018884.
[20] Repo-Carrasco-Valencia R. 2011. „Andean indigenous food crops: nutritional value and bioactive compounds”. Department of Biochemistry and Food Chemistry, University of Turku. https://www.researchgate.net/publication/264850947_Andean_indigenous_food_crops_nutritional_value_and_bioactive_compounds.
[21] Repo-Carrasco-Valencia R., A. Acevedo de La Cru, J.C. Icochea Alvarez, H. Kallio. 2009. „Chemical and functional characterization of Kañiwa (Chenopodium pallidicaule) grain, extrudate and bran”. Plant Foods For Human Nutrition 64 (2) : 94-101. DOI: 10.1007/s11130-009-0109-0.
[22] Repo-Carrasco-Valencia R., J.K. Hellström, J.-M. Pihlava, P.H. Mattila. 2010. „Flavonoids and other phenolic compounds in Andean indigenous grains: Quinoa (Chenopodium quinoa), kañiwa (Chenopodium pallidicaule) and kiwicha (Amaranthus caudatus)”. Food Chemistry 120 (1) : 128-133.
[23] Rodriguez J.P., M. Aro, M. Coarite, S.-E. Jacobsen, B. Ørting, M. Sørensen, C. Andreasen. 2017. „Seed Shattering of Cañahua (Chenopodium pallidicaule Aellen)”. Journal of Agronomy and Crop Science 203 : 254-267.
[24] Sanchez-Moreno C., J.A. Larrauri, F. Saura-Calixto. 1998. „A procedure to measure the antiradical efficiency of polyphenols”. Journal of the Science of Food and Agriculture 76 : 270-276.
[25] Singh S., R. Singh, K.V. Singh. 2016. „Quinoa (Chenopodium quinoa Willd), functional superfood for today’s world: A Review”. World Scientific News 58 : 84-96.
[26] Singleton V.L., J.A. Rossi. 1965. „Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents”. American Journal of Enology and Viticulture 16 : 144-158.
[27] Škrbić B., J. Živančev, N. Mrmoš. 2013. „Concentrations of arsenic, cadmium and lead in selected foodstuffs from Serbian market basket: Estimated intake by the population from the Serbia”. Food and Chemical Toxicology 58 : 440-448. DOI: 10.1016/j.fct.2013.05.026.
[28] Villa D.Y.G., L. Russo, K. Kerbab, M. Landi, L. Rastrelli. 2014. „Chemical and nutritional characterization of Chenopodium pallidicaule (cañihua) and Chenopodium quinoa (quinoa) seeds”. Emirates Journal of Food and Agriculture 26 (7) : 609-615. DOI: 10.9755/ejfa.v26i7.18187.
[29] Wąsowicz E., E. Kamiński. 1984. „Fatty acid composition of „Bebiko” infant formula determined by support-coated open tubular gas chromatography”. Die Nahrung 25 (6) : 599-603.
[30] www.fao.org/faostat/en/#data/QC (dostęp: 10.04.2021).
[31] Zhu N., S. Sheng, D. Li, E.J. Lavoie, M.V. Karwe, R.T. Rosen, C.-T. Ho. 2001. „Anti-oxidative flavonoid glycosides from quinoa seeds (Chenopodium Quinoa Willd.)”. Journal of Food Lipids 8 : 37-44.




