DOI 10.15199/65.2021.10.6
Małgorzata Ziarno
Dorota Zaręba
STRESZCZENIE:
Od wielu lat trwa dyskusja, czy będzie możliwa laboratoryjno-przemysłowa produkcja żywności pochodzenia zwierzęcego bez konieczności wykorzystania organizmów zwierząt. Dobrze są już znane roślinne zamienniki i substytuty produktów mięsnych czy mlecznych, roślinne substytuty miodu, jajek i ryb. Powoli godzimy się z dopuszczeniem białek z owadów do żywienia ludzi. Od niedawna pojawiła się nowa perspektywa – mikrobiologiczne substytuty przetworów mleczarskich takich jak sery. Mykoproteiny, czyli białka otrzymywane z pomocą naturalnie występujących grzybów mikroskopowych, są już wdrażane w praktyce produkcyjnej jako doskonały surowiec do otrzymania mikrobiologicznego substytutu serka śmietankowego. Postęp w technologiach biologicznych i informatycznych pozwala obecnie na rozwój precyzyjnej fermentacji w kierunku projektowania biosyntezy białek kazeiny i białek serwatkowych oraz ich użycia wraz z roślinnymi składnikami recepturowymi do produkcji wegańskich zamienników serów bez wykorzystania organizmów zwierząt.
SUMMARY:
For many years, a discussion has been in progressing whether laboratories will enable the production of animal food without the need to use animal organisms. We already know vegetable replacements and substitutes of meat or dairy products, as well as plant honey, eggs, and fish substitutes. We have reconciled with the admission of proteins from insects to humans’ food supply. Recently, a new possibility appeared – microbiological substitutes for dairy products such as cheese. Mycoproteins, i.e. proteins obtained with the help of naturally occurring microscopic fungi, are already implemented in the production practice as an excellent raw material to obtain a microbiological substitute for a creamy cheese. Progress in biological and IT technologies allows in recent years also to develop the precision fermentation towards designing biosynthesis of casein proteins and whey proteins, as well as their use together with plant origin components for the production of vegan cheese replacements without the use of animal organisms.
TITLE:
Cheeses From Microbes?
SŁOWA KLUCZOWE:
białka pojedynczych komórek mikroorganizmów, mykoproteiny, substytuty nabiału, precyzyjna fermentacja, transgeniczne białka
KEY WORDS:
single cell proteins, mycoproteins, artificial dairy, precision fermentation, transgenic proteins
Branża spożywcza zajmująca się przetwórstwem surowców pochodzenia zwierzęcego pogodziła się z obecnością roślinnych zamienników i substytutów produktów mięsnych czy mlecznych. Naukowcy już opracowali technologię mięsa z probówki i mikrobiologicznych substytutów mięsa. Już nie budzi większej sensacji pojawienie się coraz to nowszych roślinnych substytutów miodu, jajek i ryb, a nawet dopuszczenie białek z owadów do żywienia ludzi. Od niedawna pojawiła się nowa perspektywa pozyskiwania białek żywnościowych, których nie da się zaliczyć ani do białek pochodzenia zwierzęcego, ani do białek pochodzenia roślinnego. Mowa o białkach pozyskiwanych z komórek mikroorganizmów. Nadeszła pora na mikrobiologiczne substytuty przetworów mleczarskich.
Wiele już lat trwa dyskusja, czy laboratoria umożliwią produkcję żywności pochodzenia zwierzęcego bez konieczności wykorzystania organizmów zwierząt. Osiem lat temu (w 2013 r.) dwóch śmiałków podjęło się degustowania pierwszego na świecie burgera otrzymanego na szalce Petriego. Teraz naukowcy zabrali się za produkcję serów [15].
Od jakiegoś czasu mówi się o innowacyjnym źródle białek – komórkach mikroorganizmów. Białka takie są nazywane „białkami z pojedynczych komórek mikroorganizmów”, „białkami jednokomórkowymi” lub skrótowo „SCP” (z ang. single cell protein). Białka SCP, o doskonałym profilu aminokwasowym, mogą być syntetyzowane zarówno przez grzyby, bakterie, jak i glony, zaś wysoka wydajność otrzymywania białek pochodzenia mikrobiologicznego jest bardzo obiecująca. SCP mogą być produkowane na różnego rodzaju podłożach biotechnologicznych, zawierających wywary gorzelnicze, melasę, serwatkę, słomę, ługi posiarczynowe, jak również ścieki i odpady przemysłowe bogate w węglowodory (np. metan), alkohole (m.in. metanol i etanol), a nawet ścieki i różne frakcje ropy naftowej [17]. Wysoka produkcja białek z tych źródeł wynikała głównie z szybkiego tempa wzrostu mikroorganizmów oraz relatywnie wysokiej zawartości białka w ich komórkach.
Preparaty SCP są otrzymywane w formie masy suszonych komórek (biomasa), która niekiedy jest określana jako bioproteiny lub białko mikrobiologiczne. W obecnych czasach preparaty SCP mogą być dobrą alternatywą nawet dla białek roślinnych, ponieważ nie wymagają dużego obszaru ziemi lub dużych zasobów wody pitnej do produkcji. Piśmiennictwo [17, 23] podaje, że wydajność biosyntezy białka pochodzenia mikrobiologicznego jest większa niż tradycyjnych źródeł białek i wyraża się stosunkiem 100 000 do 1 oraz do 80 w porównaniu do syntezy białka przez zwierzęta (bydło) lub rośliny (soję). Biosynteza SCP jest około 500-krotnie szybsza niż białka wołowego. SCP zawiera również węglowodany, tłuszcze, minerały i witaminy [23].
SCP mogą być wykorzystywane jako suplementy lub składniki żywności bogate w białko. Preparaty SCP mają wysoki poziom niezbędnych aminokwasów, takich jak lizyna, metionina i treonina. Wykazano, że są dobrym zamiennikiem innych drogich źródeł białka, takich jak ryby i mączki sojowe. Do tej pory w praktyce przemysłowej największe znaczenie w pozyskiwaniu białka miały drożdże (m.in. Saccharomyces i Candida) oraz bakterie (np. Escherichia coli) [17]. Obecnie coraz częściej pojawiają się preparaty białek pochodzenia grzybowego, czyli mykoproteiny [4]. Są to alternatywne, pożywne źródła białka otrzymywane z pomocą naturalnie występujących grzybów mikroskopowych [20].
MYKOPROTEINA Fy™
Białko Fy™ jest otrzymywane na drodze fermentacji z grzyba wyizolowanego po raz pierwszy w 2009 r. podczas wyprawy do odległych obszarów Parku Narodowego Yellowstone [5, 12]. W 2009 r. Mark Kozubal badał kwaśne gorące źródła w Parku Narodowym Yellowstone w ramach pracy badawczej wspieranej przez Amerykańską Narodową Fundację Nauki (NSF, z ang. National Science Foundation) i NASA. Poszukiwał takie ekstremofilne mikroorganizmy, które mogłyby rozwijać się w warunkach pozaziemskich. Badacz wyizolował grzyba, który oznaczył kodem MK-7, ponieważ był to siódmy mikroorganizm, który wyizolował [5, 12]. Wkrótce ten mikroorganizm został zidentyfikowany jako Fusarium novum yellowstonensis, a następnie, po dokładnej analizie taksonomicznej i genetycznej, jako odrębny gatunek (Fusarium flavolapis) i zdeponowany w Amerykańskiej Kolekcji Szczepów Wzorcowych (ATCC, z ang. American Type Culture Collection) jako Fusarium oxysporum MK7 (pod numerem dostępu PTA – 10698) [5].
W celu otrzymania białka Fy™ czystą kulturę szczepu F. flavolapis hoduje się poprzez fermentację powierzchniową w kontrolowanych warunkach (szczególnie pod kątem temperatury i wilgotności) aż do utworzenia biomasy grzybni. Pożywka fermentacyjna jest przygotowywana zgodnie z zasadami Dobrej Praktyki Produkcyjnej i zawiera źródła węgla, azotu, soli mineralnych, ekstrakt drożdżowy i wodę. Wszystkie surowce użyte do fermentacji i namnażania grzybni spełniają kryterium czystości spożywczej lub farmaceutycznej, dlatego otrzymane białko nadaje się do spożycia. W przeciwieństwie do typowych fermentacji w podłożach bulionowych, szczep Fusarium flavolapis można hodować na dużych tacach zawierających podłoże i otrzymywać biomasę w postaci masywnej maty (tzw. „biomaty”), którą można łatwo zwijać. Wyhodowana biomasa jest zbierana, a komórki grzyba inaktywowane przez obróbkę cieplną. W celu uzyskania końcowego produktu o wysokiej zawartości białka biomasę podaje się prasowaniu, ewentualnie również suszeniu i mieleniu (wówczas powstaje wysokobiałkowa mączka). Mokra biomasa zawiera 70-80% wody, a ponadto białko (>45% w przeliczeniu na suchą masę), węglowodany (średnio 30-45% suchej masy), lipidy (5-10% suchej masy), glicerol (<4% suchej masy), popiół (<5% suchej masy) oraz kwasy rybonukleinowe (<2% suchej masy). 100 gramów preparatu białka Fusarium dostarcza ok. 97 kcal. Jak wspomniano, biomasa Fusarium może być wysuszona do postaci mączki, która zawiera około 95% suchej masy [5].
Białko Fy™ charakteryzuje się wysoką jakością żywieniową, zawiera wszystkie aminokwasy obecne w białkach spożywczych, w tym 9 aminokwasów egzogennych, których ludzki organizm nie może wytworzyć a muszą być pozyskiwane z pożywieniem (tj. izoleucyna, leucyna, histydyna, lizyna, metionina, fenyloalanina, treonina, tryptofan i walina). Niezbędne aminokwasy składają się na 20-24% całkowitej suchej masy białka Fusarium, a suma aminokwasów stanowi 40-50% całkowitej suchej masy. Aminokwasy rozgałęzione, leucyna, izoleucyna i walina stanowią 10-15% suchej masy i 20-25% całkowitej zawartości białka. W powiadomieniu GRAS [5] dostępna jest informacja, że skorygowany wskaźnik strawności aminokwasów białka (PDCAAS, z ang. Protein Digestibility-Corrected Amino Acid Score) dla białka Fy™ wynosi 0,91, czyli jest większy niż dla białka roślinnego takiego jak białko grochu (0,69) i fasoli (0,65). PDCAAS dla białka Fusarium zmierzono zarówno metodami in vitro, jak i in vivo, co dało wynik 0,92 i 0,91. Dla porównania, PDCAAS dla białek takich jak kazeina, izolaty i koncentraty białek serwatkowych, izolaty białek sojowych i jajka wynoszą 1,00, zaś dla wołowiny 0,92. Węglowodany ogółem w preparacie białka Fusarium składają się z błonnika rozpuszczalnego (3% suchej masy) i błonnika nierozpuszczalnego (średnio 28,2% suchej masy), glikogenu (2,5% suchej masy) i polisacharydów (8,7% suchej masy). Lipidy zawarte w preparacie białka Fusarium obejmują głównie kwasy tłuszczowe wielonienasycone (2,9% suchej masy) i jednonienasycone (0,6% suchej masy), a także pewną ilość kwasów tłuszczowych nasyconych (1,1% suchej masy). Nie stwierdza się obecności kwasów tłuszczowych trans-nienasyconych i cholesterolu. Dokumentacja udostępniona przez FDA [5] prezentuje również zawartość niektórych witamin i składników mineralnych w preparacie białka Fusarium (tabela 1).
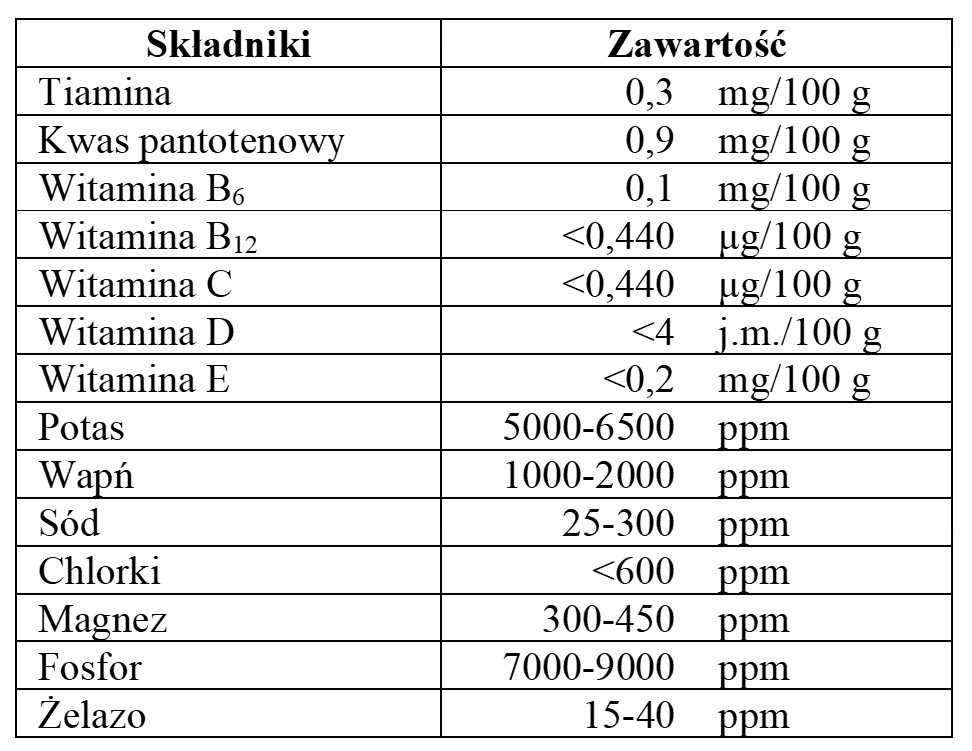
Tabela 1. Zawartość niektórych witamin i składników mineralnych w preparacie białka Fusarium
Table 1. Content of some vitamins and minerals in the Fusarium protein preparation
Badania dowodzą, że szczep Fusarium flavolapis jest niepatogenny i nietoksyczny. Jednakże podczas hodowli jest zdolny do wytwarzania mykotoksyn. Analiza genomu omawianego szczepu wykazuje jego potencjał do biosyntezy fumonizyn, beauwerycyny, fusaryny C, a także kwasu fuzarowego. Fusaryna C i kwas fusarynowy nie zostały wykryte w produkcie przemysłowo otrzymywanym, natomiast fumonizyna i beawerycyna już są stwierdzane, jednakże w ilościach znikomych. W specyfikacji końcowego produktu podano, że poziom fumonizyn wynosi <0,5 mg/kg suchej masy [5].
Amerykańska Agencja Żywności i Leków (FDA, z ang. Food and Drug Administration) przyznała białku Fusarium status GRAS. Na podstawie danych literaturowych można wnioskować, że reakcje alergiczne powodowane spożyciem żywności zawierającej białka Fusarium są bardzo rzadkie. Ponadto, białka wytwarzane przez Fusarium nie mają homologii z ośmioma głównymi alergenami pokarmowymi, a ponadto producent tego preparatu wydał oświadczenie, że niepublikowane dotąd wyniki badań w symulowanym soku żołądkowo-jelitowym dowodzą, że doustne spożycie białka Fusarium nie spowoduje reakcji alergicznej. Producent białka Fy™ stwierdza również, że białko Fusarium jest dobrze tolerowane przez osoby z problemami żołądkowo-jelitowymi (GI), takimi jak biegunka lub wymioty [5].
Producent białka Fy™ na stronie internetowej deklaruje, że proces produkcji tego białka wymaga 87% mniej wody niż produkcja wołowiny, a jednocześnie emituje o 99% mniej gazów cieplarnianych i wymaga 99% mniej gruntów, bez emisji metanu i z minimalną ilością odpadów [12]. Preparat białka Fusarium, zarówno w postaci mokrej biomasy, jak i mączki, jest pakowany w hermetyczne opakowania przeznaczone do kontaktu z żywnością i zamrażany w temperaturze -20oC lub niższej. W tych warunkach przechowywania białko jest stabilne przez co najmniej 12 tygodni [5].
Niektórzy postrzegają białko Fy™ jako „nową soję”, twierdząc, że może ono być zamiennikiem soi w każdej spożywczej aplikacji od produktów o stałej konsystencji, produktów sproszkowanych po płynne oraz od substytutów mleka po substytuty mięsa. Zebrana z hodowli biomasa ma naturalną strukturę włókien, które imitują włókna mięśniowe [12]. Jednakże na tym nie kończy się potencjał aplikacyjny białka Fusarium. Jest to bowiem doskonały surowiec do otrzymania mikrobiologicznego substytutu serka śmietankowego. Otrzymany mikrobiologiczny substytut serka śmietankowego jest biały, homogenny, łatwy do smarowania. Wyglądem przypomina naturalny serek homogenizowany. Oczywiście, białko Fusarium nie jest jedynym składnikiem takiego produktu, ale stanowi w opracowanym produkcie źródło białka mikrobiologicznego. Mikrobiologiczny substytut serka śmietankowego cechuje się deklarowaną wartością energetyczną wynoszącą ok. 286 kcal w 100 g. Poza tym w 100 g zawiera 25 g tłuszczu, 7,1 g węglowodanów, w tym 3,6 g cukrów oraz 3,6 g białka [1].
Zgodnie z zadeklarowanym przez producenta składem recepturowym, mikrobiologiczny substytut serka śmietankowego zawiera wodę, białka Fy™, olej kokosowy, cukier, sól, kwas mlekowy, gumę guar i kultury bakteryjne. Na podstawie tego składu można przypuszczać jaka jest prawdopodobna technologia tego wyrobu. Być może na bazie wody przygotowywana jest płynna mieszanka wymienionych składników, a następnie jest ona poddawana fermentacji mlekowej, której rezultatem jest charakterystyczna kremowa konsystencja i smak wyrobu. Podobna zasada technologii jest stosowana w produkcji ukwaszonych emulsji tłuszczowych, czyli substytutów śmietany, w których tłuszcz mleczny zastąpiono tłuszczami roślinnymi.
Białkiem Fusarium można również wzbogacić wiele innych produktów, wykorzystując możliwość zwiększenia wartości odżywczej środków spożywczych: od soków po chleb, gotowych posiłków i zup, suszonych makaronów, olejów i dressingów. Przewidywany poziom dodatku białka Fusarium w produkcji substytutów produktów mlecznych takich jak mleko, jogurty, śmietanka i serki mieści się w zakresie od 3,8% do 17,5% (w przeliczeniu na suchą masę).
Jak dotąd jedynym źródłem informacji o białku Fy™ są dokumentacje opublikowane na stronach internetowych FDA oraz producenta preparatu. Niestety brak jest dostępnych publikacji z renomowanych recenzowanych czasopism naukowych dotyczących białka Fy™ czy produktów go zawierających. Warto na to zwrócić uwagę, szczególnie w aspekcie analizy poziomu bezpieczeństwa białka Fy™. Jego producenci stwierdzają, że szczep Fusarium flavolapis nie stanowi znaczącego ryzyka alergii pokarmowej dla populacji ogólnej. Jednakże dokonano jedynie analizy bioinformatycznej mającej na celu określenie prawdopodobieństwa, że niektóre z jego białek są alergenami. Jednak jak wykazano w przypadku innych preparatów białek Fusarium, alergia na takie białka jest możliwa [2].
MYKOPROTEINA QUORN
Wykorzystanie Fusarium do produkcji preparatów wysokobiałkowych nie jest nowym pomysłem. Ponad 50 lat temu naukowcy z Wielkiej Brytanii wyizolowali szczep Fusarium venenatum PTA-2684, który otrzymał status GRAS w 2002 r., a produkt jego fermentacji wysokobiałkowej nazwali „mykoproteiną”. Ta mykoproteina od 1985 r. jest sprzedawana pod nazwą handlową Quorn [6, 13].
Quorn jest spożywane w 17 krajach, w tym w Stanach Zjednoczonych. Aby otrzymać Quorn, mykoproteina jest mieszana z przyprawami warzywnymi (lub innymi substancjami smakowo-zapachowymi) oraz niewielką ilością białek jaj. Proces produkcyjny rozpoczyna się tlenową fermentacją w 40-metrowych fermentorach działających w systemie ciągłym przez pięć tygodni, po czym następuje ogrzewanie do temperatury ponad 65°C (celem rozpadu kwasów nukleinowych), wirowanie, przyprawianie, parowanie, chłodzenie i zamrażanie. Quorn cechuje się wysoką zawartością białka i błonnika oraz niską zawartością tłuszczu. Mykoproteina Fusarium może pomóc w utrzymaniu prawidłowego poziomu cholesterolu we krwi, promowaniu syntezy mięśni, kontrolowaniu poziomu glukozy i insuliny oraz zwiększaniu uczuciu sytości. Odżywcze, zdrowotne i środowiskowe korzyści mykoproteiny potwierdzają jej rolę w zdrowej diecie [4, 20]. Unikatowa metoda produkcji Quorn zapewnia znacznie mniejszy ślad węglowy i wodny w porównaniu z produkcją wołowiny i drobiu [4].
Niestety błyskotliwy debiut Quorn został szybko przyhamowany pojawiającymi się problemami jej producenta. Od czasu wprowadzenia produktu na rynek producent Quorn jest nękany przez procesy sądowe kierowane przez pracowników firmy oraz konsumentów zgłaszających niepożądane reakcje alergiczne wynikające z kontaktu z białkami Fusarium [2, 9, 10, 11, 13]. Przegląd tych przypadków, które zostały opisane w piśmiennictwie naukowym, wskazuje, że częstość występowania reakcji alergicznych jest szacowana na poziomie 1/140 000 [4]. Wprawdzie ryzyko uczulenia na Quorn jest niskie, ale osoby uczulone na pleśń mogą intensywniej alergicznie reagować na mykoproteinę wziewną lub spożytą. Badania reaktywności krzyżowej dowodzą, że Quorn dzieli wiele czynników alergizujących z Aspergillus fumigatus, Cladosporium herbarum i Alternaria alternata [9, 10, 11, 13, 18].
MYKOPROTEINA ABUNDA®
Chętnych na pozyskiwanie mykoprotein Fusarium nadal nie brakuje. Firma 3F BIO wnioskuje w obecnym roku o status GRAS dla preparatu ABUNDA® z tlenowej hodowli szczepu Fusarium veneratum (pierwotnie klasyfikowanym jako Fusarium graminearum A 3/5) i zdeponowanym w National Culture Collection RHM Research, Ltd. jako IMI145425 [7, 21]. Mykoproteina ABUNDA® jest produkowana w procesie ciągłej fermentacji tlenowej w temperaturze 30oC w podłożach zawierających glukozę. Po zakończeniu hodowli, która trwa ok. 30 dni, biomasa grzybowa jest poddawana obróbce termicznej (w temperaturze z zakresu 68-73oC z przetrzymaniem przez 15 minut) i oddzielana na gorąco (po podgrzaniu do temperatury 85-95oC) metodą wirówkową od płynu pohodowlanego. W rezultacie otrzymuje się biomasę zawierającą ok. 25% suchej biomasy i 75% wody [7].
Mykoproteina ABUNDA® zawiera 54% białka w suchej masie, 6,2% lipidów, 28,9% błonnika i 3,36% popiołu. Wyznaczona wartość kaloryczna preparatu wynosi 390 kcal w przeliczeniu na 100 g suchej masy [7]. Preparat zawiera cały zestaw niezbędnych aminokwasów, a także witamin i składników mineralnych.
We wniosku przedłożonym do FDA [7] firma stwierdza, że rozwiązała problem zagrożeń wynikających ze sposobu pozyskiwania białek Fusarium veneratum ryzyko obecności substancji toksycznych takich jak kwas rybonukleinowy i mykotoksyny. Autorzy wniosku twierdzą, że zawartość RNA (a zatem również puryn) w mikoproteinie ABUNDA® została znacznie zmniejszona w wyjściowej wartości 10% suchej masy do <2% suchej masy poprzez zastosowanie temperatury hodowli wyższej niż zwyczajowo stosowanej w tego typu hodowlach. Podwyższona temperatura hodowli sprawia, że grzyb wytwarza enzym hydrolazę RNA (RNazę) rozkładającą RNA do komponentów nukleotydowych usuwanych następnie z fazą wodną na etapie termicznej inaktywacji komórek mikroorganizmu [7]. Wiadomo, że niektóre Fusarium wytwarzają mykotoksyny. Jednakże zastosowany szczep F. venenatum wykazuje brak zdolności do produkcji mykotoksyn, co potwierdziły badania zlecone przez wnioskodawcę o status GRAS [7].
Jak dotąd brak w dostępnych danych piśmiennictwa propozycji uzyskiwania z mykoproteiny ABUNDA® produktów będących substytutami przetworów mleczarskich. Jednakże, należy oczekiwać, że tak stanie się w najbliższym czasie po opublikowaniu pomysłu aplikacji białka Fy™ w tym kierunku.
SUBSTYTUTY NABIAŁU
Do opracowywania technologii mikrobiologicznych źródeł białka, w tym białka mlecznego i produkcji wegańskich alternatyw przetworów mlecznych, takich jak serki, pojawiają się kolejne start-upy. Pomysłowość biotechnologów nie kończy się na wykorzystaniu mykoprotein, ale dotyczy również rekonstrukcji kazeiny na drodze mikrobiologicznej i w ten sposób otrzymania wegańskiego sera. Wyroby żywnościowe, otrzymywane w ten sposób, mają już nadaną anglojęzyczną nazwę „artificial dairy” (czyli dosłownie „sztuczny nabiał”), zaś stosowane narzędzie określa się jako „precyzyjną fermentację” (z ang. „precision fermentation”) [15].
Precyzyjna fermentacja jest to technologia, która umożliwia zaprogramowanie komórek mikroorganizmów do wytwarzania złożonych cząsteczek organicznych, takich jak białka. Technologia nie jest nowa, jednak istotne jest to, że w ostatnich latach jej kosztochłonność ulega istotnej redukcji wskutek postępu w technologiach biologicznych i informatycznych. W 2000 roku wyprodukowanie 1 kg jednego typu cząsteczki kosztowało ok. 1 mln dolarów, teraz ten koszt w przypadku kazeiny i białek serwatkowych zmniejszył się do ok. 10 dolarów za 1 kg (a prognozowany jest dalszy intensywny spadek tych cen).
Przykładem wykorzystania precyzyjnej fermentacji są badania start-upu bioinżynieryjnego „Change Foods”, który zamierza wykorzystać różne modyfikowane genetycznie mikroorganizmy (w tym drożdże i grzyby strzępkowe) do otrzymywania kluczowych składników sera, w tym białek kazeiny, które mają być identyczne z tymi, jakie znajdują się w mleku i produktach mlecznych. Następnie składniki te zostaną połączone z innymi składnikami recepturowymi (w tym roślinnymi), aby otrzymać bezmleczne zamienniki serków, mleka czy mlecznych napojów fermentowanych [2, 14].
Wyhodowane w laboratorium białka mleka wydają się być idealnym rozwiązaniem odwiecznego problemu substytutów: smakiem i konsystencją roślinnych czy mikrobiologicznych alternatyw przetworów mleczarskich. Dla przykładu, większość wegańskich serów nie ma charakterystycznej, rozciągliwej konsystencji i zachwycającego smaku, które są typowymi i charakterystycznymi cechami prawdziwych serów z mleka. Być może, dzięki biotechnologom, wkrótce może się to zmienić. Jak na razie pomysł firmy „Change Foods” jest na etapie biosyntezy białek kazeinowych, a przed twórcami stoją jeszcze tak poważne wyzwania, jak połączenie białek kazeinowych w micele kazeinowe i opracowanie technologii wegańskich zamienników serów. W planach twórców start-upu jest również mikrobiologiczna biosynteza innych składników mleka, w tym lipidów i substancji odpowiedzialnych za zapach i smak [2].
Fermentację precyzyjną wykorzystuje również belgijska firma „The Vegetarian Butcher” prowadząc projekt pod nazwą „Vegan Cowboys” [8]. Celem projektu jest wykorzystanie metody fermentacji mikrobiologicznej do otrzymywania kazeiny konkurencyjnej cenowo wobec roślinnych zamienników produktów mleczarskich. Naukowcy zauważyli, że otrzymywanie produktów na drodze precyzyjnej fermentacji staje się bardzo potężną technologią. Informacja genetyczna definiująca biosyntezę odpowiedniego białka jest włączana do informacji genetycznej określonego mikroorganizmu, a poprzez hodowanie tego mikroorganizmu w ustalonych warunkach białko będące przedmiotem zainteresowania jest produkowane w dużych ilościach. Wiadomo, że w ten sposób, większość obecnie stosowanej podpuszczki (tzw. podpuszczki mikrobiologicznej) jest już produkowana biotechnologicznie. Może to być bardzo wydajny sposób na produkcję białek mleka [22]. Właściciele firmy przyznają jednak, że nie jest to łatwe, tym bardziej, że proces ma być konkurencyjny cenowo w stosunku do obecnego tradycyjnego sposobu produkcji, a także produkcji roślinnych zamienników serów [8].
Większe zaawansowanie w realizacji badań nad mikrobiologiczną kazeiną osiągnął zespół „New Culture”, który opanował syntetyzowanie sekwencji DNA kodującej białko kazeiny i włącza tę sekwencję do DNA mikroorganizmu, który na drodze fermentacji wydziela to białka kazeiny do płynu pohodowlanego [19]. Niestety dane dotyczące stosowanego drobnoustroju oraz technologii otrzymywania miceli kazeinowych są utajnione. Wiadomo jedynie, że stosowany mikroorganizm jest genetycznie zmodyfikowany. Twórcy projektu twierdza, że odtwarzają micele kazeiny z otrzymanych białek kazeinowych z wykorzystaniem soli wapnia i innych soli [19]. Powstałe białko, po wydzieleniu z płynu pohodowlanego i po dodaniu roślinnych cukrów i tłuszczów, przechodzi przez ten sam proces, który jest charakterystyczny dla tradycyjnego mlecznego sera [19]. W ten sposób powstaje mikrobiologiczny substytut sera Mozzarella [19].
W Stanach Zjednoczonych Ameryki powstał oddolny projekt badawczy, non-profit, „Real Vegan Cheese” (RVC), którego celem jest otrzymanie prawdziwego sera przy użyciu modyfikowanych genetycznie mikroorganizmów stających się fabrykami białek mleka [16]. Realizacja RVC jest możliwa dzięki połączonym wysiłkom naukowców pracujących w dwóch laboratoriach w rejonie zatoki San Francisco: „Counter Culture Labs” w Oakland w Kalifornii i „BioCurious” w Sunnyvale w Kalifornii [16]. Rozpoczęty w 2014 roku jako zgłoszenie do konkursu „International Genetically Engineered Machine” (iGEM), projekt pozyskał pierwsze fundusze w ramach kampanii crowdfundingowej. W 2018 r. zespół otrzymał na drodze mikrobiologicznej cztery białka: alfa-s1-, alfa-s2-, beta- i kappa-kazeiny i pomyślnie wydzielił trzy z nich (tj. alfa-s1-, alfa-s2- i kappa-kazeiny). Ten postęp osiągnięto przy wykorzystaniu zmutowanych komórek E. coli BL21 [16]. Jak na razie skala produkcji jest bardzo niewielka, ale efekty w postaci pierwszego wegańskiego sera Mozzarella są bardzo obiecujące. Prawdziwy wegański substytut sera ma być otrzymany z mieszanki transgenicznego białka (tj. pozyskanego z komórek mikroorganizmów zmodyfikowanych genetycznie) oraz tłuszczów i cukrów pochodzenia roślinnego. Proces produkcji takiego wegańskiego substytutu sera ma być identyczny do tego, jaki jest praktykowany w przypadku tradycyjnego sera i przy użyciu zwykłego mleka krowiego czy koziego.
Z kolei firma „Perfect Day” z Doliny Krzemowej w USA twierdzi, że jest w stanie na drodze biotechnologicznej produkować białka pod względem molekularnym identyczne nie tylko do białek kazeiny, ale również białek serwatki, a więc uzyskać transgeniczne prawie wszystkie białka mleka [15]. Perfect Day jest to tylko jedna z kilku firm biotechnologicznych, które rywalizują o masową produkcję wyhodowanych w laboratoriach substytutów produktów mlecznych. Jednakże brak danych publikowanych w renomowanych czasopismach naukowych odnośnie tego, jak ekologiczne i pożywne są białka mleka wytwarzane przez mikroorganizmy w laboratorium [15]. Wydaje się to niezwykle ważne, bowiem sposób związania jonów wapnia w białku mleka krowiego jest tak wyrafinowany, że determinuje sposób trawienia tych białek przez kwas żołądkowy i warunkuje bioprzyswajalność uwolnionych peptydów i aminokwasów w świetle jelita [15].
PODSUMOWANIE:
Po wielu dziesięcioleciach badania serów i stwierdzania na ich powierzchni obecności grzybów z rodzaju Fusarium, psujących żywności lub chorobotwórczych dla organizmu człowieka, okazuje się, że można je bezpiecznie wykorzystać do celów żywieniowych. Wraz z wprowadzeniem na rynek pierwszego bezmlecznego serka śmietankowego otrzymywanego z mykoprotein otwiera się kolejny rynek, którego branża mleczarska nie powinna zignorować. Unikatowa metoda produkcji mykoprotein daje znacznie zmniejszony ślad węglowy i ślad wodny w porównaniu do produkcji mięsa czy mleka. Wartość żywieniowa mykoprotein jest zgodna z bieżącymi zaleceniami dietetycznymi: wysoka zawartość białka i błonnika, niska zawartość tłuszczówy, cholesterolu, sodu i cukrów. Z żywieniowego punktu widzenia aplikacja mykoprotein do diety jest uzasadniona. Białka te mogą pomóc utrzymać zdrowy poziom cholesterolu we krwi, promować syntezę mięśni, kontrolować poziom glukozy i insuliny oraz zwiększać uczucie sytości. Systematyczny przegląd danych epidemiologicznych wskazuje, że częstość występowania reakcji alergicznych na mykoproteiny jest obecnie wyjątkowo niska, zaś obecne badania kliniczne nad tym źródłem białek koncentrują się na długoterminowych korzyściach spożywania mykoprotein.
Systemy ekspresji transgenicznych białek w komórkach prokariontów opracowuje się szybko i tanio z wykorzystaniem narzędzi inżynierii genetycznej już od wielu lat. Obecny rozwój biotechnologii pozwala już bezpiecznie produkować tym sposobem białka mleka, a ponadto dysponujemy technikami, za pomocą których można łatwo oczyścić takie białka i stosować do produkcji wyrobów żywnościowych takich jak prawdziwie wegańskie wersje białek mleka i otrzymane z nich wegańskie substytuty serów. „Droga do sukcesu nie jest prosta, ale firmy podejmujące się realizacji tego wyzwania osiągają coraz to lepsze rezultaty.
Dr hab. M. Ziarno, prof. SGGW – Wydział Nauk o Żywności, Szkoła Główna Gospodarstwa Wiejskiego w Warszawie, dr inż. D. Zaręba – Zespół Szkół Gastronomicznych im. prof. Eugeniusza Pijanowskiego w Warszawie.
e-mail: malgorzata_ziarno@sggw.edu.pl, dorotazareba@gmail.com
LITERATURA:
- Anon. 2021. „A collaborative, free and open database of food products from around the world”. Open Food Facts. https://world.openfoodfacts.org/product/0860004044703/natures-fynd-original.
- Change Foods. 2021. https://www.changefoods.com/. [dostęp: 02-08-2021].
- Dzeladini L., D. Chan, M. Kummerow. 2017. „A case report of mycoprotein allergy”. Internal Medicine Journal 47: 5-33. DOI:10.1111/imj.41_13578.
- Finnigan T., B.T. Wall, P.J. Wilde, F.B. Stephens, S.L. Taylor, M.R. Freedman. 2019. „Mycoprotein: The Future of Nutritious Nonmeat Protein, a Symposium Review”. Current Developments in Nutrition 3 (6) : nzz021. DOI:10.1093/cdn/nzz021.
- GRAS Notice (GRN) No. 904. 2021. Generally Recognized as Safe (GRAS) Notification Fermented Microbial Protein. Steptoe & Johnson, Washington, USA. https://www.fda.gov/media/142277/download. [dostęp: 02-08-2021].
- GRAS Notice (GRN) No. 91. 2002. Mycoprotein. Marlow Foods Ltd., North Yorkshire, United Kingdom, http://wayback.archive-it.org/7993/20171031053437/https://www.fda.gov/downloads/Food/IngredientsPackagingLabeling/GRAS/NoticeInventory/UCM266876.pdf. [dostęp: 02-08-2021].
- GRAS Notice (GRN) No. 945. 2021. Generally Recognized as Safe (GRAS) Notice for Mycoprotein as a Food Ingredient. 3F BIO Limited, Glasgow, United Kingdom, https://www.fda.gov/media/145554/download. [dostęp: 02-08-2021].
- Green E. 2021. „Animal-free dairy chains: Those Vegan Cowboys develop plant-based casein by precision fermentation”. Food Ingredients. https://www.foodingredientsfirst.com/news/animal-free-dairy-chains-those-vegan-cowboys-develop-plant-based-casein-by-precision-fermentation.html. [dostęp: 02-08-2021].
- Hoff M., R.M. True, B.K. Ballmer-Weber, S. Vieths, B. Wuethrich. 2003. „Immediate-type hypersensitivity reaction to ingestion of mycoprotein (Quorn) in a patient allergic to molds caused by acidic ribosomal protein P2”. The Journal of Allergy and Clinical Immunology 111 (5) : 1106-1110. DOI:10.1067/mai.2003.1339.
- Jacobson M.F., J. De Porter. 2018. „Self-reported adverse reactions associated with mycoprotein (Quorn-brand) containing foods”. Annals of Allergy, Asthma & Immunology 120 (6) : 626-630. DOI:10.1016/j.anai.2018.03.020.
- Katona S.J., E.R. Kaminski. 2002. „Sensitivity to Quorn mycoprotein (Fusarium venenatum) in a mould allergic patient”. Journal of Clinical Pathology 55 (11) : 876-879. DOI:10.1136/jcp.55.11.876-a.
- Nature’s Fynd. 2021. https://www.naturesfynd.com/. [dostęp: 02-08-2021].
- O’Donnell K., E. Cigelnik, H.H. Casper. 1998. „Molecular Phylogenetic, Morphological, and Mycotoxin Data Support Reidentification of the Quorn Mycoprotein Fungus as Fusarium venenatum”. Fungal Genetics and Biology 23 (1) : 57-67. doi.org/10.1006/fgbi.1997.1018.
- O’Halloran Y. 2020. „New startup uses fungi to create vegan cheese”. Living Vegan, https://www.livingvegan.com/new-startup-uses-fungi-to-create-vegan-cheese/. [dostęp: 02-08-2021].
- Plackett B. 2021. „Entrepreneurs Recruit Microbes to Make Moo-Free Dairy”. Inside Science. https://www.insidescience.org/news/entrepreneurs-recruit-microbes-make-moo-free-dairy. [dostęp: 02-08-2021].
- Real Vegan Cheese Project. 2021. https://www.realvegancheese.org/. [dostęp: 02-08-2021].
- Sharif M., M.H. Zafar, A.I. Aqib, M. Saeed, M.R. Farag, M. Alagawany. 2021. „Single cell protein: Sources, mechanism of production, nutritional value and its uses in aquaculture nutrition”. Aquaculture 531: 735-885. DOI:10.1016/j.aquaculture.2020.735885.
- Van Durme P., J.L. Ceuppens, P. Cadot. 2003. „Allergy to ingested mycoprotein in a patient with mold spore inhalant allergy”. Journal of Allergy and Clinical Immunology 112 (2) : 452-454. DOI:10.1067/mai.2003.1613.
- Watson E., 2019. „‘Real’ cheese… without cows? New Culture makes mozzarella with milk proteins via microbial fermentation. FoodNavigator-USA.com. https://www.foodnavigator-usa.com/Article/2019/06/24/Real-cheese-without-cows-New-Culture-makes-mozzarella-with-milk-proteins-via-microbial-fermentation. [dostęp: 02-08-2021].
- Wociór A., D. Złotkowska, H. Kostyra, E. Kostyra. 2010. „Mikoproteiny”. ŻYWNOŚĆ. Nauka. Technologia. Jakość 5 (72) : 5-16.
- Yoder W.T., L.M. Christianson. 1998. „Species-Specific Primers Resolve Members of Fusarium Section Fusarium. Taxonomic Status of the Edible «Quorn» Fungus Re-evaluated”. Fungal Genetics and Biology 23 (1) : 68-80. DOI:10.1006/fgbi.1997.1027.
- Zaręba D., M. Ziarno. 2011. „Enzymy w mleczarstwie – aspekty technologiczne i prawne”. Przemysł Spożywczy 7/8 : 54-57.
- Ziarno M., D. Zaręba. 2018. „Białka nie tylko dla sportowców”. Forum Mleczarskie Biznes 3: 9-11.




